Ngày nay, tính hiệu quả và an toàn của thuốc ngày càng được quan tâm bởi bệnh nhân và các bác sĩ. Vì vậy, việc chứng minh chất lượng của sản phẩm generic tương tự các sản phẩm brand name luôn là thách thức lớn đối với các nhà sản xuất thuốc. Ở nhiều quốc gia, đặc biệt ở các nước phát triển, dữ liệu tương đương sinh học là một phần bắt buộc trong hồ sơ đăng ký thuốc. Một số công cụ như chất lượng theo thiết kế (QbD), thiết kế thí nghiệm (DoE), tương quan In vitro – In vivo (IVIVC) và sử dụng hệ thống phân loại dược phẩm sinh học (BCS) được áp dụng nhằm giảm các thử nghiệm tương đương sinh học.
IVIVC là một trong những công cụ hiệu quả nhất để đánh giá mối quan hệ giữa độ hòa tan in vitro (sự giải phóng thuốc trong các môi trường khác nhau) và in vivo (nồng độ thuốc trong huyết tương). IVIVC là một phương pháp toán học đánh giá sự tương quan trên dựa trên các mô phỏng điều kiện pH của đường tiêu hóa. Thông thường, đối với các sản phẩm có nhiều hàm lượng, nghiên cứu tương đương sinh học (BE) in vivo chỉ tiến hành với hàm lượng cao nhất. Nếu các hàm lượng khác không tương đồng giữa tỉ lệ nồng độ hoạt chất trên tá dược với hàm lượng đã được nghiên cứu BE, thì phải tiến hành nghiên cứu BE in vivo trên tất cả hàm lượng. Tuy nhiên, với kết quả IVIVC tin cậy, yêu cầu đối với nghiên cứu BE in vivo về các hàm lượng nói trên có thể được miễn trừ, nếu tất cả các hàm lượng đều như nhau về chất lượng, có cùng cơ chế giải phóng, có phóng thích in vitro tương tự, được sản xuất bằng cùng một loại thiết bị và cùng một quy trình sản xuất tại cùng một địa điểm như hàm lượng đã thử BE.
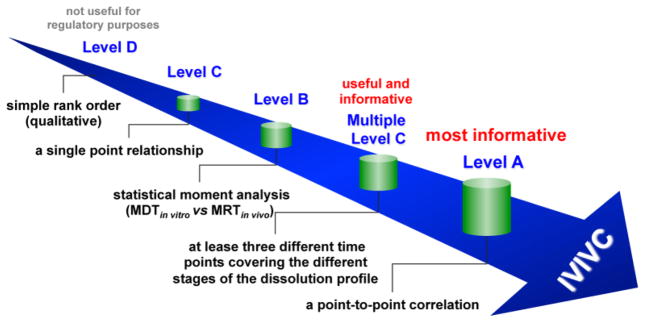
Theo FDA, các loại IVIVC bao gồm:
- Mức A: Mối tương quan nói chung là tuyến tính và thể hiện mối quan hệ điểm – điểm giữa độ hòa tan trong in vitro và kết quả in vivo. Đây là mức phổ biến nhất được FDA chấp thuận.
- Mức B: So sánh thời gian hòa tan trung bình in vitro với thời gian lưu trú trung bình hoặc thời gian hòa tan trung bình trong cơ thể.
- Mức C: Loại này thiết lập mối quan hệ 1 điểm giữa thông số hòa tan và thông số dược động học.
- Mức C nhiều điểm: Tương quan một hoặc một số thông số dược động học quan trọng đến lượng thuốc được hòa tan tại một số thời điểm của thử nghiệm độ hòa tan in vitro.
- IVIVC cấp độ A và cấp độ C nhiều điểm thường được áp dụng nhiều nhất.
Quá trình xây dựng IVIVC bắt đầu bằng việc phát triển các công thức có tỷ lệ phóng thích khác nhau (các công thức với nồng độ polymer kiểm soát khuếch tán khác nhau), tiếp theo là tiến hành thử độ hòa tan trong in vitro và nghiên cứu in vivo. Các kết quả thu được ở trên được dùng để ước tính tương quan thời gian hấp thụ hoặc hòa tan in vivo bằng cách sử dụng một phương pháp toán học thích hợp cho từng công thức và đối tượng.
Như đã đề cập ở trên, mục đích chính của việc phát triển IVIVC là giảm số lượng các nghiên cứu tương đương sinh học trên người. IVIVC có thể áp dụng cho các trường hợp miễn thử tương đương sinh học trong một số trường hợp nhất định như thay đổi phương pháp hòa tan, các hàm lượng khác nhau trong một sản phẩm (đã đề cập ở trên), thay đổi giữa các lô với nhau hay thay thế khi nghiên cứu BE thất bại.
NGUỒN THAM KHẢO
- Applications of In Vitro–In Vivo Correlations in Generic Drug Development: Case Studies.
- Extended Release Oral Dosage Forms: Development, Evaluation, and Application of In Vitro/In Vivo Correlations.
- In vitro-In vivo Correlation: Perspectives on Model Development.
- In vitro – In vivo correlation in the development of oral drug formulation: A screenshot of the last two decades.