1. Giới thiệu chung [1]–[4]
Đái tháo đường (ĐTĐ) là một trong những bệnh mạn tính ngày càng phổ biến hiện nay. Theo Liên đoàn đái tháo đường Thế giới (IDF) công bố năm 2021, cứ 10 người lớn độ tuổi 20 – 79 tuổi có 1 người mắc đái tháo đường, trong đó khoảng 90% bệnh nhân mắc ĐTĐ type 2. Tỉ lệ người trẻ mắc ĐTĐ hiện nay ngày càng tăng do lối sống và di truyền. Vì vậy, việc nghiên cứu thuốc điều trị bệnh lý này đang trở thành xu hướng cho các công ty dược phẩm hàng đầu thế giới.
Thuốc ức chế SGLT2 được phát triển để điều trị ĐTĐ type 2 thông qua việc ức chế tái hấp thu glucose ở ống lượn gần tại thận. Trong đó canagliflozin là hoạt chất tiềm năng đầu tiên trong nhóm được FDA phê duyệt trong điều trị với tên thương mại INVOKANA®. INVOKANA® thường dùng đơn trị liệu hay cùng với các hoạt chất khác, kết hợp với chế độ ăn uống và tập luyện. INVOKANA® còn được FDA chấp thuận thêm một số chỉ định như giảm các nguy cơ đau tim, đột quy và các biến chứng tim mạch ở bệnh nhân ĐTĐ type 2. Ngày 30 tháng 9 năm 2019, FDA chấp thuận cho điều trị suy thận do ĐTĐ và giảm rủi ro nằm viện do suy tim ở bệnh nhân mắc ĐTĐ Type 2 và suy thận do ĐTĐ.
Bài viết về hoạt chất canagliflozin và thuốc gốc INVOKANA® do SEN Pharma tổng hợp sẽ cung cấp các thông tin hết sức thú vị về:
- Tổng quan về hoạt chất canagliflozin
- Quá trình nghiên cứu và phát triển của thuốc gốc INVOKANA®
- Kết quả kinh doanh của thuốc gốc INVOKANA® kể từ khi ra mắt
- Những lưu ý trong quá trình nghiên cứu thuốc generic canagliflozin
SEN Pharma tự hào là đối tác của Unipharm, nhà phân phối nguyên liệu hàng đầu tại Trung Quốc hiện đang sở hữu nguồn nguyên liệu canagliflozin chất lượng, đầy đủ tài liệu và giá thành hợp lý. Với mạng lưới hơn 100 nhà máy sản xuất nguyên liệu tại Trung Quốc và danh mục hơn 700 APIs, Unipharm sẽ là đối tác tiềm năng cho các nhà máy sản xuất Dược phẩm tại Việt Nam không chỉ đối với canagliflozin mà còn nhiều dược chất khác.
2. Tổng quan về canagliflozin [5], [6]
INVOKANA® (canagliflozin) được xem là một trong những thuốc hiệu quả trong điều trị ĐTĐ type 2 không phụ thuộc vào sự phóng thích insulin và tăng nhạy cảm với insulin. Cơ chế chính của canagliflozin là thuốc ức chế chọn lọc kênh đồng vận chuyển glucose và natri 2 (SGLT2), giảm sự tái hấp thu glucose. 90% glucose được lọc tại cầu thận tái hấp thu qua thụ thể SGLT2 ở ống lượn gần. Ưu điểm của canagliflozin là không ảnh hưởng đến thụ thể SGLT2 ở ruột non.
INVOKANA® được phát triển bởi Tanabe Seiyaku Ltd (hiện tại là Mitsubishi Tanabe Pharma Corporation), và được cấp phép cho Janssen phát triển và kinh doanh. INVOKANA® có dạng bào chế là viên nén bao phim chứa canagliflozin hemihydrat tương ứng 100 mg và 300 mg canagliflozin. INVOKANA® hiện được chỉ định điều trị 1 viên mỗi ngày với liều khởi đầu 100 mg, sử dụng trước bữa ăn nhằm kiểm soát đường huyết. Bệnh cạnh điều trị bằng thuốc, kết hợp với sự điều chỉnh chế độ ăn uống và lối sống đóng vai trò quan trọng trong điều trị ĐTĐ type 2.
3. Quá trình nghiên cứu thuốc gốc INVOKANA® [1]–[8]
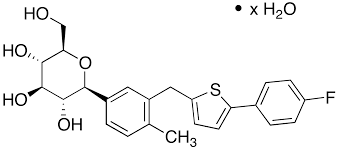
Về cấu trúc hóa học, Canagliflozin là C-glycoside gắn với các dị vòng thơm (heteroaromatic ring) (như hình vẽ). Nhóm C-glycoside cho thấy hoạt tính ức chế nhóm SGLT2, ít bị chuyển hóa trong cơ thể. Dẫn chất thiophene cho hoạt tính ức chế tối ưu. Thêm nhóm (4-fluorophenyl) cho hoạt lực in vivo và độ ổn định tốt. Từ các nghiên cứu trên in vivo, chất TA-7284/JNJ-28431754 (canagliflozin) được đưa vào thử nghiệm lâm sàng.

Hồ sơ đăng ký thuốc phát minh (IND) của Canagliflozin được mở ngày 25 tháng 5 năm 2007, trong cùng thời gian FDA đưa ra hướng dẫn về “Đái tháo đường-Đánh gaiá rủi ro tim mạch trên các liệu trình điều trị Đái tháo đường type 2” được ban hành. Hướng dẫn áp dụng cho tất cả các liệu trình điều trị ĐTĐ mới đang được nghiên cứu. Nghiên cứu Canagliflozin đang tiến hành phase 2 khi hướng dẫn trên ban hành. Do đó, thử nghiệm phase 3 được thiết kế với kế hoạch loại trừ mức đô không được chấp nhận của các rủi ro liên quan đến tim mạch. Thiết kế với tên gọi CANVAS được tiến hành bởi Janssen cùng với một vài thử nghiệm phase 3 để chứng minh tính an toàn trên biến chứng tim mạch. Các thử nghiệm về tính hiệu quả và an toàn của canagliflozin được tiến hành trên 9 thử nghiệm lâm sàng với hơn 10.285 bệnh nhân ĐTĐ type 2. Trong những nghiên cứu trên, canagliflozin cải thiện mức độ A1c và glucose máu lúc no.
Ngày 5 tháng 6 năm 2012, Janssen Research and Development thông báo dữ liệu của 5 thử nghiệm lâm sàng, nghiên cứu về hiệu quả và an toàn canagliflozin.
Đến ngày 31 tháng 5 năm 2012, Janssen nộp hồ sơ chính thức đăng ký thuốc mới Canagliflozin cho điều trị ĐTĐ type 2.
Ngày 27 tháng 5 năm 2013, tập đoàn Mitsubishi Tanabe Pharma thông báo rằng công ty đã nộp hồ sơ lên bộ Sức khỏe, Lao động và Phúc lợi Nhật Bản xin phê duyệt cho hoạt động sản xuất và kinh doanh cho hoạt chất TA-7284
Ngày 29 tháng 3 năm 2013, Canagliflozin là thuốc ức chế SLGT2 đầu tiên được FDA chấp thuận trong điều trị ĐTĐ.
Ngày 27 tháng 05 năm 2013, Canagliflozin được chấp thuận ở Nhật Bản cho điều trị ĐTĐ type 2.
Ngày 18 tháng 11 năm 2013, Canagliflozin được chấp thuận ở châu Âu cho điều trị ĐTĐ type 2.
Ngày 26 tháng 5 năm 2014, INVOKANA® được bộ y tế Canada chấp thuận cho hạ đường huyết trên bệnh nhân ĐTĐ type 2.
Ngày 2 tháng 9 năm 2014, tập đoàn Mitsubishi Tanabe Pharma và Daiichi Sankyo thông báo rằng cả 2 công ty được phép đưa ra thị trường sản phẩm CANAGLU 100mg cho điều trị ĐTĐ type 2.
Tháng 7 năm 2017, kết quả chương trình CANVAS cho thấy rằng INVOKANA® giảm đáng cơ nguy cơ biến chứng tim mạch, tử vong ở bệnh nhân bị ĐTĐ type 2.
Ngày 30 tháng 10 năm 2018, FDA chấp thuận cho chỉ định giảm nguy cơ đau tim, đột quy và các biến chứng tim mạch trên bệnh nhân ĐTĐ type 2.
Ngày 30 tháng 9 năm 2019, FDA chấp thuận cho điều trị suy thận do ĐTĐ và giảm rủi ro nằm viện do suy tim của bệnh nhân mắc ĐTĐ type 2 và suy thận do ĐTĐ.
4. Tình hình kinh doanh của INVOKANA® từ khi ra mắt [7]–[9]
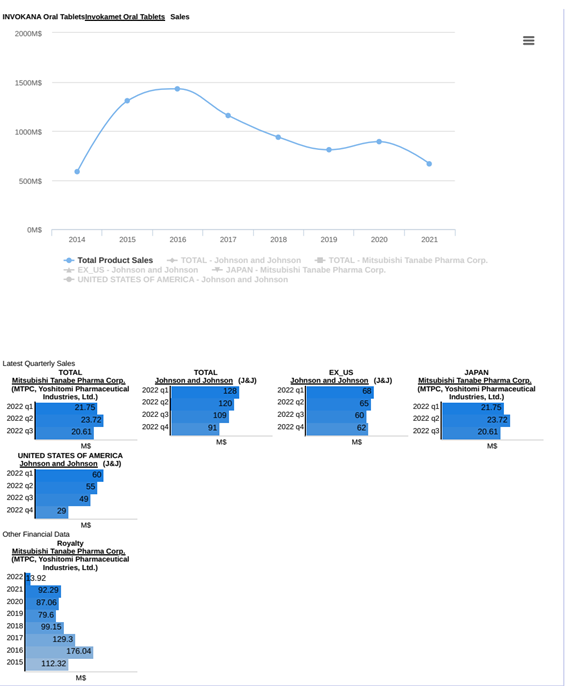
Kể từ khi ra mắt đến năm 2014, doanh thu của INVOKANA® tăng trưởng đáng kể trong 2 năm đầu. Doanh thu của INVOKANA® đạt cao nhất vào năm 2016 với gần 1,5 tỷ USD được thu về. Tuy nhiên, trong giai đoạn từ 2016 đến nay, doanh thu của thuốc này có xu hướng giảm dần sau các năm do các nghiên cứu lâm sàng đã chỉ ra các tác dụng không mong muốn như nhiễm toan ceton, giảm mật độ xương…. Tháng 5 năm 2017, FDA yêu cầu đưa nguy cơ cắt cụt chi dưới vào “box warning” của nhãn hộp thuốc INVOKANA®. Tuy nhiên, Đến tháng 8 năm 2020, FDA đã bỏ yêu cầu trên sau khi phân tích dữ liệu 3 thử nghiệm lâm sàng.
Doanh thu của thuốc vẫn rất ấn tượng, với gần 1 tỉ USD mỗi năm trong giai đoạn 2018 – 2020, , trong đó, Mỹ và Nhật Bản là thị trường chính. Hai kênh kinh doanh chính của INVOKANA® là Johnson & Johnson và Mitsubishi Tanabe Pharma.
Ở thị trường Việt Nam, INVOKANA® có số đăng ký cho cả 2 hàm lượng 100mg và 300 mg, dưới dạng chai x 30 viên.
5. Những lưu ý khi nghiên cứu thuốc generic canagliflozin [10]
Các patent liên quan đến hoạt chất và bào chế được sở hữu bởi Janssen và Mitsubishi Tanabe Pharma, tiêu biểu như
- Patent hoạt chất: US 7943582B2 Crystalline form of 1-(β-D-glucopyransoyl)-4-methyl-3-[5-(4-fluorophenyl)-2- thienylmethyl]benzene hemihydrate ngày hết hạn 26/02/2029
- Patent bào chế: US 10617668B2 Pharmaceutical formulations, ngày hết hạn 11/05/2031
Để chuẩn bị cho quá trình nghiên cứu công thức và nộp hồ sơ đăng kí thì các công ty sản xuất thuốc generic ở Việt Nam đã bắt đầu tìm kiếm nguồn nguyên liệu canagliflozin nhằm đáp ứng nhu cầu điều trị trong nước ngay khi patent hoạt chất hết hiệu lực (khoảng đầu năm 2029).
Để tăng khả năng nghiên cứu thành công, cần chú ý một số vấn đề như sau:
- Kích thước hạt: Kích thước hạt hoạt chất nên được kiểm soát để cho sản phẩm đồng nhất. Tuy nhiên, kích thước hạt không ảnh hưởng đến hoạt tính in vivo.
- Canagliflozin tồn tại ở 2 dạng đa hình, trong đó Form I (dạng muối hemihydrat) ổn định hơn Form II nên được sản xuất trong các quy trình tổng hợp thương mại.
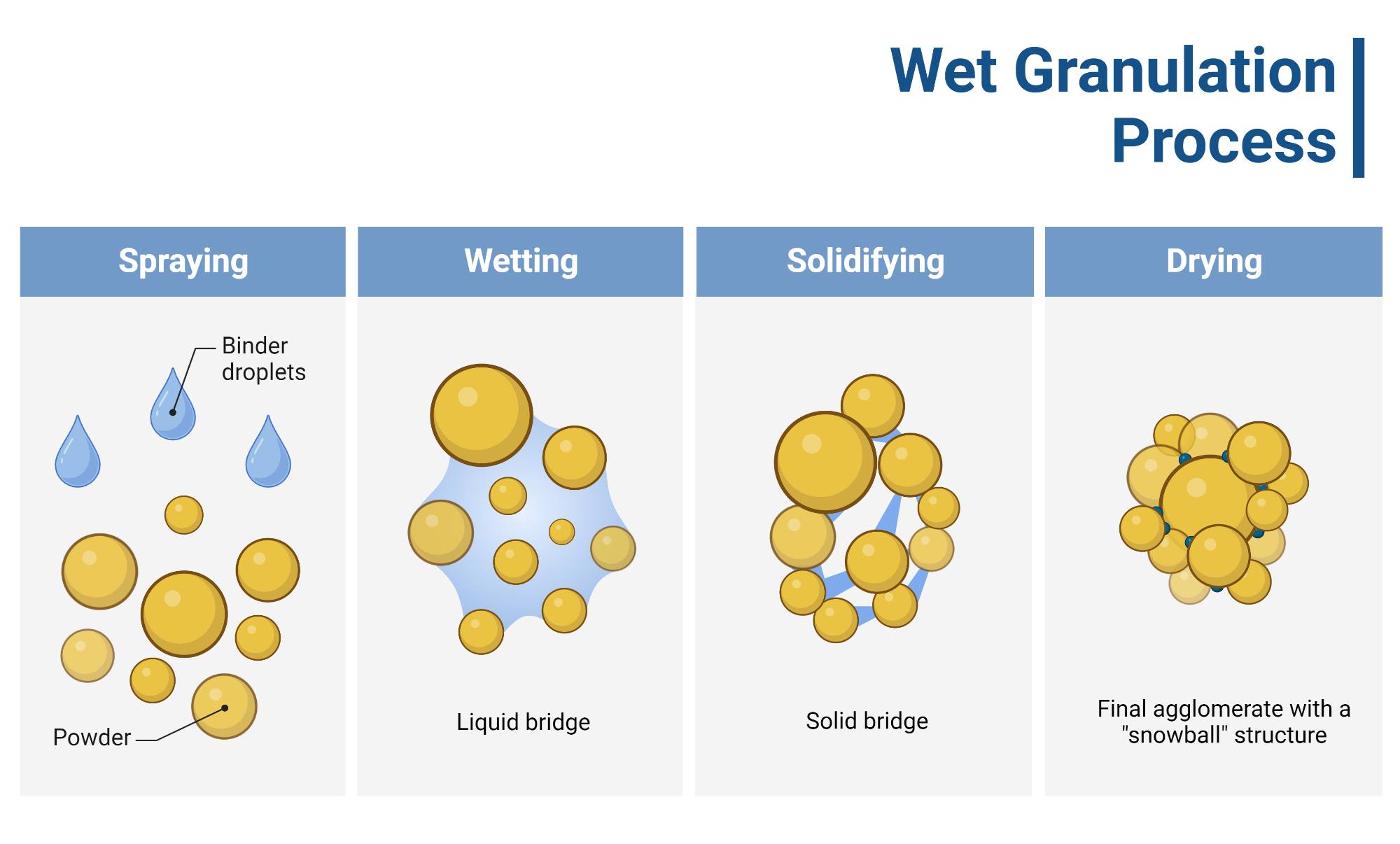
- Phương pháp bào chế viên nén bao phim INVOKANA® hàm lượng 100 mg và 300 mg là tạo hạt tầng sôi (fluid bed granulation). Cả 2 hàm lượng được sản xuất từ cùng 1 cốm (công thức tỉ lệ với hàm lượng).
- Hoạt chất bền với nhiệt và ẩm, tuy nhiên, bị thủy phân trong môi trường base và peroxide. Canagliflozin nhạy với ánh sáng và điều kiện oxi hóa.
NGUỒN THAM KHẢO
- “Khoảng 5 triệu người Việt đang mắc căn bệnh gây nhiều biến chứng về tim mạch, thần kinh, cắt cụt chi…” Cổng thông tin điện tử Bộ Y tế (2022)
- “U.S. FDA approves Johnson & Johnson diabetes drug, canagliflozin | Reuters.” (2013)
- “CENTER FOR DRUG EVALUATION AND RESEARCH Approval Package for: APPLICATION NUMBER: 204042Orig1s032,” FDA (2019).
- “FDA Advisory Panel Supports Diabetes Drug Canagliflozin.” (2013)
- “Canagliflozin: A Novel SGLT2 Inhibitor for Type 2 Diabetes Mellitus,” S. Kaushal, H. Singh, P. Thangaraju, and J. Singh (2014)
- “First Results from Phase 3 CANVAS Trial Show Canagliflozin as Add-on Therapy to Insulin Lowered Blood Sugar Levels in Patients with Type 2 Diabetes at an Elevated Risk for Cardiovascular Disease (NYSE:JNJ).” (2012)
- “Home – PharmaCircle.”
- “FDA pulls J&J’s Invokana boxed warning after reviewing amputation risks—but the sales damage is done | Fierce Pharma.” (2020)
- “FDA Drug Safety Communication: FDA revises label of diabetes drug canagliflozin (Invokana, Invokamet) to include updates on bone fracture risk and new information on decreased bone mineral density | FDA.” FDA (2015)
- “Committee for Medicinal Products for Human Use (CHMP) Assessment report” (2013)