Tài liệu (Document) rất quan trọng, bao gồm tất cả các khía cạnh, lĩnh vực trong nhà máy dược phẩm và là một phần không thể thiếu của thực hành tốt sản xuất thuốc.
Để triển khai thực hành tài liệu hiệu quả, đáp ứng đầy đủ các yêu cầu của GLP/GMP/ISO và FDA, mô hình “DOCUMENTS” đã được áp dụng nhằm liệt kê các lĩnh vực cần thiết để thực hiện tài liệu GMP, bao gồm:
▪️ D = Design, Development, Deviations, Dossiers & Drug Master Files for regulated markets, Distribution records.
▪️ O = Operational procedures/techniques/methods, Out of specifications (OOS), Out of trend (OOT).
▪️ C = Cleaning, Calibration, Controls, Complaints, Containers & closures, Contamination & change control.
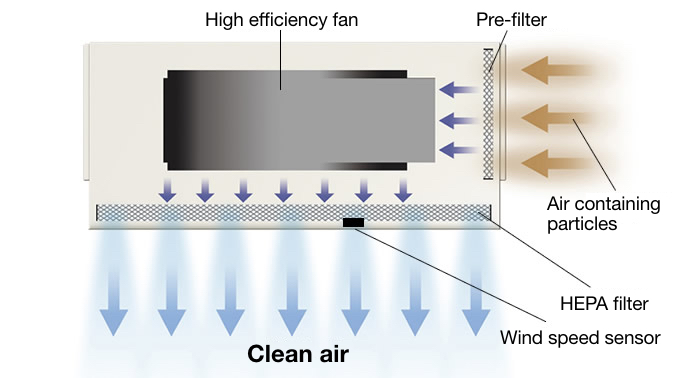
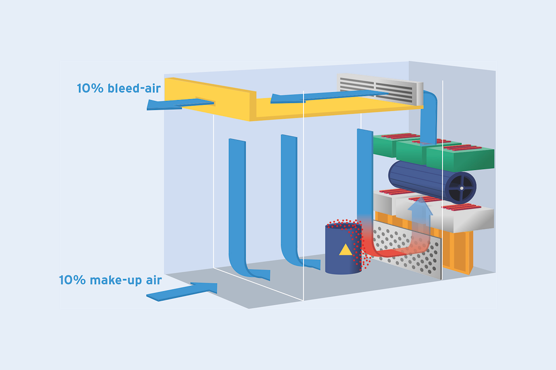
▪️ U = User requirement specifications, Utilities like water systems, HVAC, AHU.
▪️ M = Man, Materials, Machines, Methods, Maintenance, Manufacturing operations & controls, Monitoring, Master formula, Manuals (quality, safety & environment), Medical records.
▪️ E = Engineering control & practices, Environment control, Equipment qualification documents.
▪️ N = Non-routine activities, New products & substances.
▪️ T = Technology transfer, Training, Testing, Trend analysis, Technical dossiers.
▪️ S = SOPs, Safety practices, Sanitation, Storage, Self-inspection, Standardization, Supplier qualification, Specifications & standard test procedures & site master file.

NGUỒN THAM KHẢO:
MANUFACTURING DOCUMENTATION IN PHARMACEUTICAL INDUSTRY- DEVELOPMENT AND IMPLEMENTATION