Rosuvastatin / Rosuvastatin calcium
Mục lục
1. Thông tin chung
| Tên hoạt chất |
Rosuvastatin [1] |
Rosuvastatin calcium [2] |
| Cấu trúc |  |
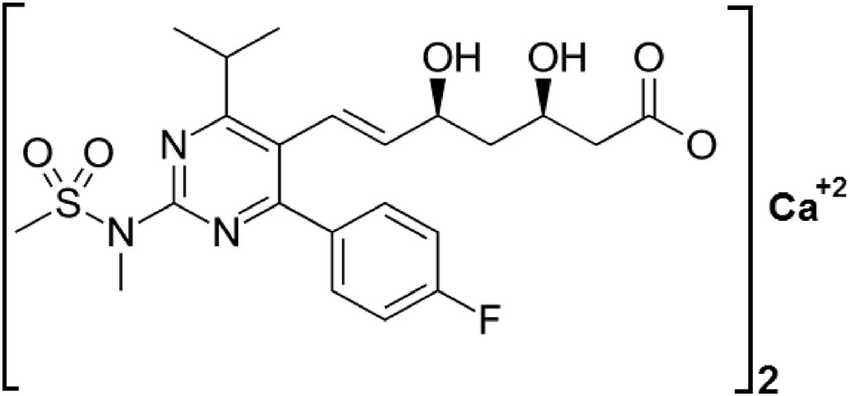 |
| CTPT | ||
| KLPT |
481.5 |
1001.1 |
| Nhóm dược lý |
Statins – ETC |
Statins – ETC |
2. Biệt dược gốc và các dạng bào chế trên thị trường
2.1. Đơn chất [3] [4]
|
STT |
Dạng bào chế | Tên biệt dược |
|
1 |
Viên nén, viên nén bao phim | Crestor |
|
2 |
Viên nang cứng | Ezallor Sprinkle |
2.2. Dạng phối hợp [3]
|
STT |
Hoạt chất phối hợp | Dạng bào chế | Tên biệt dược |
|
1 |
Ezetimibe | Viên nén | Roszet |
|
2 |
Fenofibric acid | Viên nang cứng | Stafen® 135/20 mg, Stafen® 135/5 mg |
3. Tính chất lý hóa
| Tên họat chất | Rosuvastatin calcium |
| Mô tả | Có dạng bột màu trắng, chất rắn vô định hình [5] [6] |
| Tính tan | Tan vô hạn trong acetonitrile, hòa tan trong metanol, tan ít trong nước và ethanol [5]. |
| Độ tan trong nước | 7.8 mg/mL tại 37°C [6] |
| BCS Class | II [7] |
| Dạng đa hình | Một số dạng đa hình như A, B, B1, M, R, S [8], [7], [9], [10]. |
| Nhiệt độ nóng chảy | 173-185°C [11] |
| Tính hút ẩm | Có tính hút ẩm [5] |
| Tính nhạy cảm với ánh sáng | Rosuvastatin calcium dưới điều kiện ánh sáng (Photodegradation) bị phân hủy thành dẫn xuất dihydrophenanthrene [12]. |
| pKa | 4.6 [6] |
| pH | Là hợp chất ưa nước có hệ số octanol/nước là 0,13 ở pH = 7,0 [13]. |
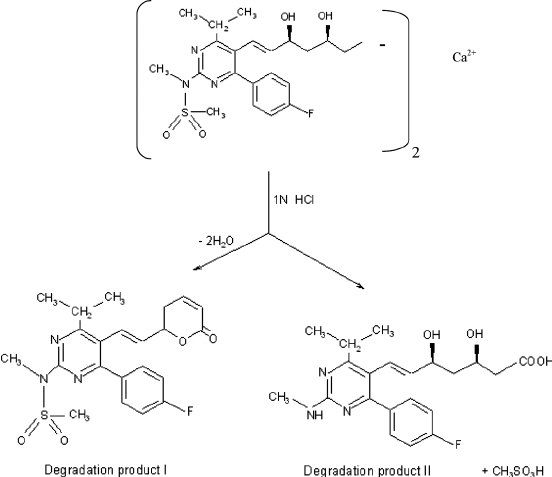
| Tính chất hóa học | Trong môi trường acid, Rosuvastatin Calcium bị thủy phân thành 2 sản phẩm phụ [14].
|
| Độ ổn định | Rosuvastatin Calcium bị oxy hóa, thủy phân, phân hủy bởi ánh sáng và phân hủy nhiệt trong môi trường thử nghiệm nghiên cứu điều kiện khắc nghiệt. Sự phân hủy chính lên đến 57% xảy ra trong điều kiện acid, 36% trong điều kiện base, 32% trong điều kiện oxy hóa, 15% phân hủy bởi nhiệt và 30% phân hủy trong điều kiện ánh sáng [15]. |
| Bảo quản | Bảo quản trong bao bì kín, tránh ánh sáng, 20-25ºC. Tránh ẩm [13]. |
4. Chuyên luận Dược Điển [16]
| Monograph | Dược Điển |
| Rosuvastatin Calcium | JP, USP, EP, IP |
| Rosuvastatin Calcium Tablets | JP |
| Rosuvastatin Tablets | USP, EP, IP |
5. Nhà sản xuất API [17]
6. Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
(Chỉ dành cho tài khoản VIP)
6.1. Kinh nghiệm thực tế:
-
- Những lưu ý khi xây dựng công thức:
6.2. Tài liệu cho xây dựng công thức
Patent EP1223918B1: AstraZeneca tiết lộ dược phẩm trong đó có rosuvastatin, cải thiện độ ổn định với một muối vô cơ là cation đa hóa trị, tốt hơn là muối calcium [7].
Patent EP1144389B1: AstraZeneca tiết lộ dạng đa hình A của rosuvastatin calcium và các chế phẩm dược phẩm dược chất này [8].
Patent EP1663989B1: AstraZeneca cũng tuyên bố các dạng đa hình B, B1 của rosuvastatin calcium và dược phẩm [18].
Patent CA2662919A1: Khảo sát thành phần công thức bào chế Rosuvastatin calcium để cải thiện độ ổn định của hoạt chất [19].
Patent EP2805714B1: Cải thiện độ hòa tan của Rosuvastatin calcium bằng dạng vô định hình bằng cách khảo sát lựa chọn các loại tá dược tối ưu nhất, tỉ lệ phù hợp, xây dựng công thức thử nghiệm. Đánh giá thử nghiệm giải phóng hoạt chất, sinh khả dụng so với thuốc gốc Crestor® [20].
Nghiên cứu của: thiết kế, phát triển viến nén Rosuvastatin calcium dạng vô định hình cai thiện độ hòa tan. Sử dụng dibasic calcium phosphate ngăn cản tính chất hút ẩm của dược chất, ngoài ra giúp làm tăng pH trong dạ dày, tăng khả năng hòa tan của rosuvastatin. Dibasic calcium phosphate kết hợp với monohydrat lactose hòa tan trong nước giúp công thức ổn định [21].
Tài liệu tham khảo
[1] “Rosuvastatin | C22H28FN3O6S – PubChem.” https://pubchem.ncbi.nlm.nih.gov/compound/Rosuvastatin#section=Computed-Properties (accessed Jul. 25, 2022). [2] “Rosuvastatin calcium | C44H54CaF2N6O12S2 – PubChem.” https://pubchem.ncbi.nlm.nih.gov/compound/Rosuvastatin-calcium (accessed Jul. 25, 2022). [3] “DailyMed – Search Results for ROSUVASTATIN.” https://dailymed.nlm.nih.gov/dailymed/search.cfm?labeltype=all&query=ROSUVASTATIN&pagesize=200&page=1 (accessed Jul. 25, 2022). [4] “Cục Quản lý Dược – Bộ Y tế.” https://dichvucong.dav.gov.vn/congbothuoc/index (accessed Jul. 02, 2022). [5] D. J. Cada, T. Levien, and D. E. Baker, “Rosuvastatin Calcium,” Hosp. Pharm., vol. 39, no. 1, pp. 52–65, 2004, doi: 10.1177/001857870403900107. [6] C. Efficacy and S. Populations, “PBS Information : Restricted Benefit . PRODUCT INFORMATION.” [7] E. P. Specification, “* EP001223918B1 *,” vol. 99, no. 19, pp. 1–10, 2003. [8] “Europäisches Patentamt European Patent Office EUROPEAN PATENT SPECIFICATION.” [9] “US Patent Application for NEW POLYMORPHIC FORM OF CRYSTALLINE ROSUVASTATIN CALCIUM & NOVEL PROCESSES FOR CRYSTALLINE AS WELL AS AMORPHOUS ROSUVASTATIN CALCIUM Patent Application (Application #20190127334 issued May 2, 2019) – Justia Patents Search.” https://patents.justia.com/patent/20190127334 (accessed Jul. 31, 2022). [10] “WO2011074016 NOVEL POLYMORPHIC FORMS OF ROSUVASTATIN CALCIUM AND PROCESS FOR PREPARATION OF THE SAME.” https://patentscope.wipo.int/search/en/detail.jsf?docId=WO2011074016 (accessed Jul. 31, 2022). [11] “FORMULATION DEVELOPMENT AND SOLUBILITY ENHANCEMENT OF ROSUVASTATIN CALCIUM TABLET PREPARED BY COMPLEXATION WITH β-CYCLODEXTRIN BY KNEADING METHOD | INTERNATIONAL JOURNAL OF PHARMACEUTICAL SCIENCES AND RESEARCH.” http://ijpsr.com/bft-article/formulation-development-and-solubility-enhancement-of-rosuvastatin-calcium-tablet-prepared-by-complexation-with-β-cyclodextrin-by-kneading-method/?view=fulltext (accessed Jul. 31, 2022). [12] M. Litvić, K. Šmic, V. Vinković, and M. Filipan-Litvić, “A study of photodegradation of drug rosuvastatin calcium in solid state and solution under UV and visible light irradiation: The influence of certain dyes as efficient stabilizers,” J. Photochem. Photobiol. A Chem., vol. 252, pp. 84–92, Jan. 2013, doi: 10.1016/J.JPHOTOCHEM.2012.11.008. [13] Fda and Cder, “HIGHLIGHTS OF PRESCRIBING INFORMATION,” Accessed: Jul. 29, 2022. [Online]. Available: www.fda.gov/medwatch. [14] Y. H. Lee et al., “Synthesis and characterization of Rosuvastatin calcium impurity A; a HMG-CoA reductase inhibitor,” Tetrahedron Lett., vol. 58, no. 26, pp. 2614–2617, 2017, doi: 10.1016/j.tetlet.2017.05.075. [15] H. O. Kaila, M. A. Ambasana, R. S. Thakkar, H. T. Saravaia, and A. K. Shah, “A New Improved RP-HPLC Method for Assay ofRosuvastatin Calcium in Tablets,” Indian J. Pharm. Sci., vol. 72, no. 5, p. 592, Sep. 2010, doi: 10.4103/0250-474X.78526. [16] “药品标准查询-药物在线数据库.” https://www.drugfuture.com/standard/search.aspx (accessed Jul. 02, 2022). [17] “Cục Quản lý Dược – Bộ Y tế.” https://dichvucong.dav.gov.vn/congbonguyenlieu (accessed Jul. 02, 2022). [18] M. A. Pyrimidin–yl, “* EP001663989B1 *,” vol. 1, no. 2, pp. 437–444, 2009. [19] “CA2662919A1.pdf.” . [20] T. Tepzz, “Tepzz 8z57_4b_t (11),” vol. 1, no. 19, pp. 1–15, 2017. [21] R. González, M. A. Peña, N. S. Torres, and G. Torrado, “Design, development, and characterization of amorphous rosuvastatin calcium tablets,” PLoS One, vol. 17, no. 3, p. e0265263, Mar. 2022, doi: 10.1371/JOURNAL.PONE.0265263.