Rivaroxaban
Mục lục
1. Thông tin chung
| Tên hoạt chất |
Rivaroxaban |
| Cấu trúc | 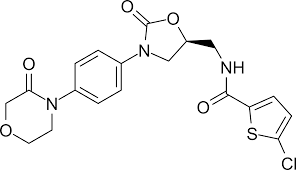 |
| CTPT | C19H18ClN3O5S |
| KLPT | 435,9 |
| Nhóm dược lý | Thuốc chống đông máu |
2. Biệt dược gốc và các dạng bào chế trên thị trường
2.1. Đơn chất
|
Dạng bào chế |
Tên biệt dược |
|
|
1 |
Viên nén bao phim |
Xarelto film coated tablets |
|
2 |
Bột pha hỗn dịch |
XARELTO for oral suspension |
| 3 | Viên nén phân tán |
Xarelto OD |
2.2. Dạng phối hợp
Chưa có dạng kết hợp
3. Tính chất lý hóa
| Tên họat chất |
Rivaroxaban |
|
Mô tả |
Bột màu trắng đến hơi vàng [1] |
| Tính tan |
Tan nhẹ trong dung môi hữu cơ (acetone, polyethylene glycol 400), gần như không tan trong nước và môi trường nước có pH 1-9 (tan từ 5-7 mg/L ở 25°C, không phụ thuộc pH) [2] |
| Độ tan trong nước |
25,05 mg/L (25°C) [3] |
| BCS Class |
II[3] |
| Dạng đa hình | Rivaroxaban tinh thể có 3 dạng thù hình. Chỉ có dạng thù hình I là ổn định về mặt nhiệt động lực học và được sử dụng trong các sản phẩm thương mại [3] |
| Nhiệt độ chảy |
230°C (form I), 203°C (form II), điểm chuyển đổi (form III) khoảng 127°C [4] |
| Tính hút ẩm |
Không hút ẩm [5] |
| Tính nhạy cảm với ánh sáng |
Bền sáng [6] |
| pKa |
pKa (Strongest Acidic): 13,6 pKa (Strongest Basic): -1,6 [7] |
| pH | – |
| Tính chất hóa học | Nghiên cứu ở các điều kiện khắc nghiệt cho thấy hoạt chất bền trong môi trường oxy hóa, quang phân và nhiệt phân, không bền trong môi trường kiềm và acid. Tốc độ thủy phân trong môi trường acid chậm hơn nhiều so với môi trường kiềm[8]
Rivaroxaban dễ bị thủy phân trong môi trường acid sinh ra hai tạp chất giống cấu trúc với hai trong ba tạp chất được sinh ra trong môi trường kiềm [9] |
| Độ ổn định | Nghiên cứu khắc nghiệt viên nén Xarelto dưới điều kiện nhiệt độ, độ ẩm và ánh sáng cao cho kết quả viên nén bền với nhiệt, ẩm và ánh sáng.[10] |
| Bảo quản |
Bảo quản trong bao bì kín, tránh ánh sáng |
4. Chuyên luận Dược Điển
Chưa có chuyên luận trong dược điển
5. Nhà sản xuất API
- Symed labs Limited (Unit -I) (Ấn Độ)
- Zhejiang Supor Pharmaceuticals Co., Ltd. (Trung Quốc)
- Zhejiang Huahai Pharmaceutical Co. Ltd (Trung Quốc)
- Ruyuan Hec Pharm (Trung Quốc)
- NEULAND LABORATORIES LIMITED (Ấn Độ)
6. Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
(Chỉ dành cho tài khoản VIP)
6.1. Kinh nghiệm thực tế
API có độ tan thấp, độ hòa tan viên kém. Độ hòa tan phụ thuộc kích thước hạt Rivaroxaban, nên dùng nguyên liệu dạng micronized để tăng độ hòa tan.
6.2. Tài liệu cho xây dựng công thức
Patent US9415053B2: Patent gốc mô tả công thức và quy trình bào chế viên nén bao phim Xarelto
Patent EP 3505160 A1: Patent mô tả công thức và quy trình bào chế viên nén bao phim chứa Rivaroxaban bằng phương pháp dập thẳng
Patent US20140248349: Patent mô tả công thức và quy trình bào chế viên nén bao phim chứa Rivaroxaban bằng phương pháp tạo hạt nóng chảy hoặc bằng phương pháp dập thẳng.
Patent WO 2016/166733 A1: Patent mô tả công thức và quy trình bào chế viên nén bao phim chứa Rivaroxaban bằng phương pháp xát hạt ướt dùng các dung môi hữu cơ isopropyl alcohol và dichloromethane.
Patent WO 2014/191446: Patent mô tả công thức và quy trình bào chế viên nén bao phim chứa Rivaroxaban, hoạt chất được nghiền với một tá dược dính thân nước, kết hợp thêm natri lauryl sulfate (SLS) với vai trò chất diện hoạt.
Các patent WO 2011/042156 A1, WO 2010/146179 A2, WO 2010/003641 A1: Mô tả phương pháp và quy trình bào chế viên nén bao phim chứa Rivaroxaban
Patent WO 2006/072367, EP2317980A2: Patent mô phương pháp và quy trình bào chế viên nén phóng thích biến đổi chứa Rivaroxaban
Patent JP2021195335A, CN 110946835 A, CN104644577A: Patent mô tả phương pháp và quy trình bào chế viên nén phân tán nhanh chứa Rivaroxaban
Tài liệu tham khảo
[1] “Rivaroxaban | C19H18ClN3O5S – PubChem.” https://pubchem.ncbi.nlm.nih.gov/compound/Rivaroxaban#section=Computed-Properties (accessed Oct. 10, 2022). [2] “Rivaroxaban | C19H18ClN3O5S – PubChem.” https://pubchem.ncbi.nlm.nih.gov/compound/Rivaroxaban#section=Computed-Properties (accessed Oct. 10, 2022). [3] CHMP, “7 Westferry Circus • Canary Wharf • London E14 4HB • United Kingdom Committee for Medicinal Products for Human Use (CHMP) Assessment report Xarelto rivaroxaban,” 2011, Accessed: Oct. 10, 2022. [Online]. Available: www.ema.europa.eu [4] E. Medicines Agency, “Committee for Medicinal Products for Human Use (CHMP) Assessment report Forxiga dapagliflozin”, Accessed: Oct. 10, 2022. [Online]. Available: www.ema.europa.eu [5] R. Mylan, “Committee for Medicinal Products for Human Use (CHMP) Assessment report,” 2021, Accessed: Oct. 10, 2022. [Online]. Available: www.ema.europa.eu/contact [6] CHMP, “7 Westferry Circus • Canary Wharf • London E14 4HB • United Kingdom Committee for Medicinal Products for Human Use (CHMP) Assessment report Xarelto rivaroxaban,” 2011, Accessed: Oct. 10, 2022. [Online]. Available: www.ema.europa.eu [7] “Rivaroxaban: Uses, Interactions, Mechanism of Action | DrugBank Online.” https://go.drugbank.com/drugs/DB06228 (accessed Oct. 10, 2022). [8] “(PDF) Investigation of the profile and kinetics of degradation of Rivaroxaban using HPLC, TLC-densitometry and LC/MS/MS: Application to pre-formulation studies.” https://www.researchgate.net/publication/272360452_Investigation_of_the_profile_and_kinetics_of_degradation_of_Rivaroxaban_using_HPLC_TLC-densitometry_and_LCMSMS_Application_to_pre-formulation_studies (accessed Oct. 10, 2022). [9] M. Amer Al-Mardini, H. Ghazal, and F. Al-Lahham, “Stability-Indicating, Method, for the Determination, of Rivaroxaban, and its Degradation, Products, using, LC-MS, and, TLC,” Research J. Pharm. and Tech, vol. 11, no. 1, 2018, Accessed: Oct. 10, 2022. [Online]. Available: www.rjptonline.org [10] CHMP, “7 Westferry Circus • Canary Wharf • London E14 4HB • United Kingdom Committee for Medicinal Products for Human Use (CHMP) Assessment report Xarelto rivaroxaban,” 2011, Accessed: Oct. 10, 2022. [Online]. Available: www.ema.europa.eu
