Naproxen / Naproxen sodium
Mục lục
1. Thông tin chung
| Tên hoạt chất | Naproxen [1] | Naproxen sodium [2] |
| Cấu trúc | 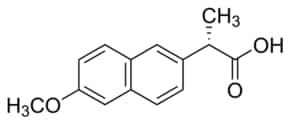 |
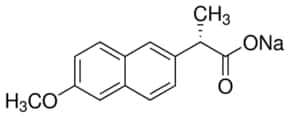 |
| CTPT | C14H14O3 | C14H13NaO3 |
| KLPT | 230.26 | 252.24 |
| Nhóm dược lý | NSAID – OTC | NSAID – OTC |
2. Biệt dược gốc và các dạng bào chế trên thị trường
2.1. Đơn chất
|
STT |
Dạng bào chế | ||
| Naproxen | Naproxen sodium | ||
|
1 |
Viên nén | Naprosyn ® | Anaprox®, Anaprox® DS |
|
2 |
Thuốc đặt | Naprosyn Sup 500mg | – |
|
3 |
Hỗn dịch | Naprosyn ® | – |
|
4 |
Viên nén phóng thích kéo dài | EC-Naprosyn® | Naprelan |
|
5 |
Bao phim | – | Naprelan |
|
6 |
Viên nang mềm | – | Aleve Easy Open Arthritis Cap |
2.2. Dạng phối hợp
|
STT |
Hoạt chất phối hợp | Dạng bào chế | Tên biệt dược | |
|
1 |
Lansoprazole | Viên nang mềm phóng thích kéo dài | Prevacid NapraPAC, Prevacid NapraPAC 500, Prevacid NapraPAC 375 | |
|
2 |
Esomeprazole magnesium trihydrate | Viên nén phóng thích kéo dài | Vimovo | |
|
3 |
Diphenhydramine | Viên nén | Aleve PM | |
|
4 |
Pseudoephedrine | Viên nén | Aleve-D Sinus & Cold, Aleve-D Sinus & Headache, Sinus & Cold D, Sudafed 12 Hour Pressure+Pain | |
|
5 |
Hydrocodone bitartrate | Viên nén bao | Doxu® 7.5/250 mg, Doxu® 5/250 mg | |
|
6 |
Acetaminophen + | Viên nén, viên bao | Movidol® | |
-
- Dạng muối naproxen sodium
|
STT |
Hoạt chất phối hợp | Dạng bào chế | Tên biệt dược |
|
1 |
Sumatriptan succinate | Viên nén, bao phim | Treximet |
|
2 |
Pseudoephedrine hydrochloride | Viên nén, bao phim, phóng thích kéo dài | Sudafed Sinus and Pain 12 Hour |
|
3 |
Diphenhydramine hydrochloride | Viên nén, bao phim | Aleve PM |
3. Tính chất lý hóa
| Tên họat chất | Naproxen | Naproxen sodium |
| Mô tả | Màu trắng, dạng tinh thể hoặc bột kết tinh, không mùi [3] | Màu trắng, hút ẩm, dạng bột kết tinh [3] |
| Tính tan | Thực tế không tan trong nước, tan trong methanol, ethanol [3] | Tan vô hạn trong nước, methanol. Ít tan trong ethanol [3] |
| Độ tan trong nước | 15.9 mg/L (at 25 °C) [1] | 0.0299 mg/mL [4] |
| BCS Class | II [5] | N/A |
| Nhiệt độ nóng chảy | 152°C | N/A |
| Tính hút ẩm | N/A | Dễ hút ẩm [6] |
| pKa | 4.15 [1] | 4.19 [4] |
| pH | Hệ số phân chia octanol/nước của naproxen ở pH 7.4 là 1.6 đến 1.8. pH của hỗn dịch trong khoảng 2.2 – 3.7 [7]. | N/A |
| LogP | 3.18 [1] | 3.18 [4] |
| Tính chất hóa học | Naproxen bị phân hủy sinh học bởi nấm, tảo và vi khuẩn (loài Bacillus thuringiensis B1 (2015b)) [8] | Naproxen sodium tồn tại ở một dạng khan và bốn dạng ngậm nước: một monohydrat, hai dihydrat và một tetrahydrat.:
• Naproxen sodium anhydrous là dạng thương mại hóa; • Naproxen sodium monohydrated, thu được bằng cách dehydrate hóa naproxen sodium dihydrated. • Naproxen sodium dihydrated thu được bằng cách cho naproxen sodium anhydrous tiếp xúc với 55% RH. • Naproxen sodium dihydrated thu được khi kết tinh naproxen sodium từ nước. • Dạng tetrahydrated thu được bằng cách để Naproxen sodium anhydrous ở 75% RH [9] |
| Độ ổn định | Thử nghiệm nghiên cứu độ ổn định trong môi trường acid, base, oxy hóa trong thời gian 6h; ánh sáng có kiểm soát, ánh sáng không kiểm soát, thủy phân ở 80°C thời gian 7 ngày cho thấy naproxen ổn định tại các môi trường và thời gian thử nghiệm [10]. | NA |
| Bảo quản | Trong bao bì kín, tránh ánh sáng trực tiếp [3] | Trong bao bì kín, tránh ánh sáng trực tiếp [3] |
4. Chuyên luận Dược Điển
| Monograph | Dược Điển |
| Naproxen | JP, BP, USP, EP, IP |
| Naproxen Sodium | BP, USP, EP, IP |
| Naproxen Oral Suspension | BP, USP, IP |
| Naproxen Suppositories | BP, IP |
| Naproxen Tablets | BP, USP, IP |
| Naproxen Sodium Tablets | USP, IP |
| Gastro-resistant Naproxen Tablets | BP |
| Naproxen Sodium and Pseudoephedrine Hydrochloride Extended-Release Tablets | USP |
| Naproxen Delayed-Release Tablets | USP |
| Naproxen Sustained-release Tablets | IP |
5. Nhà sản xuất API
6. Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
(Chỉ dành cho tài khoản VIP)
6.1. Kinh nghiệm thực tế:
-
- Những lưu ý khi xây dựng công thức:
6.2. Tài liệu cho xây dựng công thức
Patent EP0601508B1: Thiết kế naproxen 4 lớp, bên ngoài bao bằng hỗn dịch chất lỏng, giúp hoạt chất giải phóng có kiểm soát. Lớp đầu tiên luôn chứa polyetylen glycol tiếp xúc với hạt tạo rào cản tránh ảnh hưởng bởi pH, lớp bao thứ 2 chứa thành phần ưa nước, lớp phủ thứ 3 chứa thành phần ưa dầu, và lớp phủ ngoài cùng luôn chứa cellulose acetate phthalate (CAP) có đặc tính tạo lớp phủ trong ruột với chất hóa dẻo [11].
Nghiên cứu của M. H. H. Ensom và cộng sự (2015): Thử nghiệm độ ổn định của naproxen hỗn dịch (25 mg/mL) được bào chế bằng cách nghiền viên nén 250 mg naproxen và cho vào trong các loại bao bì bảo quản bao gồm: chai thủy tinh, chai nhựa và ống tiêm nhựa trong điều kiện nhiệt độ là 25°C và 4°C. Theo dõi trong vòng 3 tháng về đặc điểm màu sắc, mùi, vị và tỉ lệ thu hồi bằng thiết bị HPLC. Kết quả, hỗn dịch không có thay đổi gì về màu sắc, mùi vị và tất cả các hỗn dịch duy trì hơn 90% nồng độ ban đầu. Kết luận, hỗn dịch naproxen ổn định khi được bảo quản trong chai thủy tinh và nhựa (25 °C hoặc 4 °C) hoặc ống tiêm (25 °C) [12].
Tài liêu tham khảo
[1] “Naproxen | C14H14O3 – PubChem.” https://pubchem.ncbi.nlm.nih.gov/compound/156391#section=Melting-Point (accessed Jul. 24, 2022). [2] “Naproxen sodium | C14H13NaO3 – PubChem.” https://pubchem.ncbi.nlm.nih.gov/compound/Naproxen-sodium (accessed Jul. 24, 2022). [3] E. Pharmacopoeia, “Naproxenum,” no. 1, pp. 3333–3335, 2017. [4] “Naproxen sodium | DrugBank Online.” https://go.drugbank.com/salts/DBSALT000949 (accessed Jul. 24, 2022). [5] M. Allesø, N. Chieng, S. Rehder, J. Rantanen, T. Rades, and J. Aaltonen, “Enhanced dissolution rate and synchronized release of drugs in binary systems through formulation: Amorphous naproxen-cimetidine mixtures prepared by mechanical activation,” J. Control. Release, vol. 136, no. 1, pp. 45–53, May 2009, doi: 10.1016/J.JCONREL.2009.01.027. [6] “US2010151012A1_Description_20220715_1810.” . [7] C. Thrombotic, “NAPROSYN (naproxen) Suspension Rx only WARNING: RISK OF SERIOUS CARDIOVASCULAR AND GASTROINTESTINAL EVENTS.” [8] D. Wojcieszyńska and U. Guzik, “Naproxen in the environment: its occurrence, toxicity to nontarget organisms and biodegradation,” Appl. Microbiol. Biotechnol., vol. 104, no. 5, pp. 1849–1857, Mar. 2020, doi: 10.1007/S00253-019-10343-X/FIGURES/4. [9] L. Malaj, “SCHOOL OF ADVANCED STUDIES IN PHARMACEUTICAL SCIENCES XXI CYCLE IMPACT OF SOLID STATE PROPERTIES OF SODIUM NAPROXEN HYDRATES ON THEIR TECHNOLOGICAL PERFORMANCE,” 2009. [10] K. T. Rao and L. V. Rao, “A Validated Stability-Indicating UHPLC Method for Determination of Naproxen and Its Related Compounds in Bulk Drug Samples,” Am. J. Anal. Chem., vol. 4, pp. 286–292, 2013, doi: 10.4236/ajac.2013.46036. [11] “EP 0 601 508 B1.” [12] M. H. H. Ensom, D. Décarie, and K. Lingertat-Walsh, “Stability of extemporaneously compounded naproxen 25 mg/mL suspension in glass and plastic bottles and plastic syringes,” Can. J. Hosp. Pharm., vol. 68, no. 6, pp. 489–491, Nov. 2015, doi: 10.4212/CJHP.V68I6.1509.
