Montelukast sodium
Mục lục
1. Thông tin chung
| Tên dược chất
Thông số |
Montelukast sodium |
| Cấu trúc | 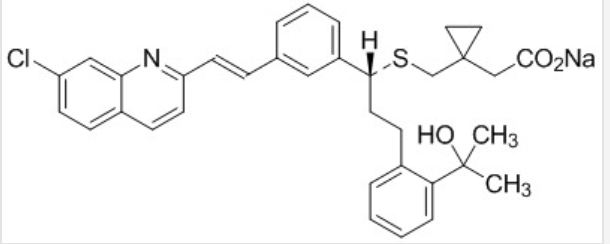 |
| Công thức phân tử | C35H35ClNNaO3S |
| KLPT | 608,2 |
| Hệ số chuyển đổi | 1 g montelukast sodium tương ứng với 0,964g montelukast. |
| Nhóm tác dụng dược lý | Chất đối kháng thụ thể Leukotrien – ETC |
2. Biệt dược gốc và các dạng bào chế trên thị trường
2.1. Đơn chất
| STT | Dạng bào chế | Tên biệt dược |
| 1 | Viên nén | Singulair |
| 2 | Viên nhai | Singulair |
| 3 | Thuốc cốm | Singulair |
Dạng bào chế phổ biến tại Việt Nam: viên nhai, viên nén bao phim, viên nén phân tán, viên nang và thuốc cốm.
2.2. Dạng phối hợp:
| STT | Hoạt chất | Dạng bào chế | Tên biệt dược |
| 1 | Desloratadin | Viên nén bao phim | Aircomb, Descase |
| Viên nhai | Desmont | ||
| 2 | Levocetirizine dihydrochlohydric | Viên nén bao phim | Airpass, Cetmont |
| Viên nhai | Brocriptin | ||
| Viên nang | Bronchorest, Renestex | ||
| Thuốc cốm | Levmont |
3. Tính chất lý hóa
| Montelukast Sodium | |
| Mô tả | Dạng bột màu trắng hoặc trắng ngà và chuyển sang màu vàng khi tiếp xúc ánh sáng |
| Tính tan | Dễ tan trong ethanol, methanol, water và không tan trong acetonitrile. |
| Độ tan (thực nghiệm) | >100 mg/ml, 25oC |
| BCS Class | |
| Nhiệt độ nóng chảy | 135,5oC |
| Tính hút ẩm | Dược chất hút ẩm. |
| pKa | 4,4 |
| pH | |
| Tính chất hóa học | Dược chất có thể bị phân hủy, sinh tạp chất dưới tác động của ánh sáng, nhiệt độ, độ ẩm và tác nhân oxi hoá. Trong đó, tạp C (EP) hình thành do quá trình oxi hóa dược chất; tạp G (EP) hình thành khi dược chất tiếp xúc với ánh sáng.
Dược chất hút ẩm, chuyển sang màu vàng và sinh tạp. |
| Độ ổn định | Cần có các biện pháp cải thiện độ ổn định cho thành phẩm, ví dụ như: sàng lọc hệ tá dược phù hợp để tránh sinh tạp; sử dụng bao bì chống ẩm, chống ánh sáng tốt…) |
4. Chuyên luận Dược Điển
| Monograph | Dược Điển |
| Montelukast sodium | USP, BP, EP, JP |
| Montelukast Sodium Tablets | USP, BP, JP |
| Montelukast Sodium Chewable Tablet | USP, BP, JP |
| Montelukast Sodium Oral Granules | USP, BP, JP |
5. Nhà sản xuất API
-
- Zhejiang Tianyu Pharmaceutical Co., Ltd (China)
- Morepen Laboratories Limited (India)
- Laurus Labs Private Limited (India)
- Metrochem Api Private Limited (India)
- Unimark Remedies Ltd (India)
- Mylan Laboratories Limited (Unit-1) (India)
- MSN Pharmachem Private Limited (India)
- Anwita Drugs & Chemicals PVT. LTD (India)
6. Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
Chỉ dành cho tài khoản VIP
Kinh nghiệm thực tế:
-
- Những lưu ý khi xây dựng công thức:
- Dược chất có tính hút ẩm mạnh và dễ bị oxi hoá nên cần hạn chế sử dụng các tá dược có tính hút ẩm và tính oxi hoá mạnh.
- Sử dụng nhiệt độ trong quy trình nghiên cứu công thức và sự ma sát trên bề mặt kim loại có nguy cơ phát sinh tạp.
- Thành phẩm khi lưu độ ổn định sẽ có nguy cơ dược chất phân hủy, sinh tạp (tạp C có giới hạn 1,7% và các tạp khác có giới hạn khoảng 0.2%) và chuyển màu vàng. Do đó, có thể cân nhắc việc sử dụng tá dược màu cho viên bao phim để khắc phục vấn đề cảm quan của viên.
Tài liệu cho xây dựng công thức:
-
- Patent EP 1818057B1 (2010) [3]:
- Sàng lọc tính tương kỵ giữa montelukast sodium với các tá dược để điều chế viên nén bao phim.
- Mô tả các công thức và phương pháp bào chế viên nhân và so sánh độ ổn định với thuốc gốc Singulair.
- Patent EP 1441701B1 (2008) [4]:
- Mô tả các tá dược có thể sử dụng để điều chế thuốc cốm montelukast sodium.
- Phương pháp và quy trình bào chế thuốc cốm montelukast sodium.
- Patent EP 2158911A1 (2010) [5]:
- Mô tả các tá dược có thể sử dụng để điều chế viên nén montelukast sodium.
- Các công thức điều chế viên nén bao phim và viên nhai
- Patent WO 2012/064302A2 [6]
- Nghiên cứu cải thiện độ ổn định bằng cách khảo sát các tá dược trơn bóng thay thế cho magnesi stearat trong viên nén bao phim
- Patent CN-105338969-A [7]
- Nghiên cứu tạo hạt montelukast và levocetirizine để cải thiện độ ổn định và che vị bằng cách tạo phức với cyclodextrin.
Tài liệu tham khảo
[1] M. M. al Omari, R. M. Zoubi, E. I. Hasan, T. Z. Khader, and A. A. Badwan, “Effect of light and heat on the stability of montelukast in solution and in its solid state,” Journal of pharmaceutical and biomedical analysis, vol. 45, no. 3, pp. 465–471, Nov. 2007, doi: 10.1016/J.JPBA.2007.07.014.
[3] “EP1818057B1 – Stable pharmaceutical formulations of montelukast sodium – Google Patents.”
[4] “EP1441701B1 – Montelukast-granulatformulierung – Google Patents.”
[5] “EP2158911A1 – Stable pharmaceutical formulations of montelukast sodium – Google Patents.”
[6] “WO2012064302A2 – Improved montelukast formulations – Google Patents.”
