Linagliptin
Mục lục
1. Thông tin chung
| Tên hoạt chất |
Linagliptin |
| Cấu trúc | 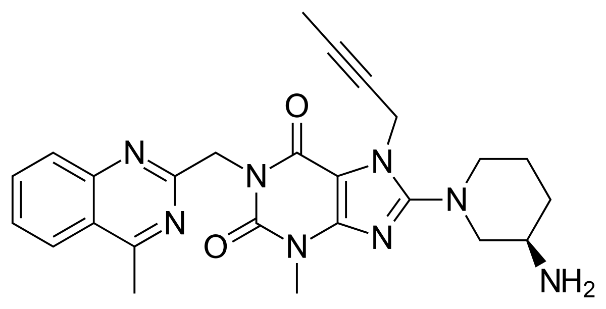 |
| CTPT |
C25H26N8O2 |
| KLPT |
472,54 |
| Nhóm dược lý |
Thuốc điều trị đái tháo đường type II – ETC |
2. Biệt dược gốc và các dạng bào chế trên thị trường
2.1. Đơn chất
|
STT |
Dạng bào chế | Tên biệt dược |
|
1 |
Viên nén bao phim | Trajenta |
2.2. Dạng phối hợp
|
STT |
Hoạt chất phối hợp | Dạng bào chế | Tên biệt dược |
|
1 |
Empagliflozin | Viên nén bao phim | Glyxambi |
|
2 |
Metformin hydrochloride | Viên nén bao phim | Trajenta Duo |
|
3 |
Empagliflozin, Metformin hydrochloride | Viên nén tác dụng kéo dài | Trijardy XR |
3. Tính chất lý hóa
| Tên hoạt chất | Linagliptin |
| Mô tả | Dạng bột tinh thể, màu trắng đến vàng |
| Tính tan | Tan trong methanol (60 mg/ml), khó tan trong ethanol (10 mg/ml), khó tan trong aceton (1 mg/ml), rất khó tan trong isopropanol (<1 mg/ml) |
| Độ tan trong nước[1] | 0,9 mg/ml |
| BCS Class | III |
| Dạng đa hình[2] | Linagliptin có hai dạng đa hình A và B có thể chuyển đổi thuận nghịch ở nhiệt độ phòng. Cả hai dạng đa hình có cùng độ hòa tan và ổn định, do đó tính đa hình không ảnh hưởng đến sinh khả dụng. |
| Nhiệt độ nóng chảy | 190-196°C |
| Tính hút ẩm[1] | Không /ít hút ẩm |
| Tính nhạy cảm với ánh sáng[3] | Không nhạy cảm với ánh sáng |
| pKa[4] | pKa1 = 1,9; pKa2 = 8,6 |
| pH | N/A |
| Tính chất hóa học[5], [6] | Ở dạng rắn, linagliptin ổn định với nhiệt độ và độ ẩm cao.
Trong môi trường acid, linagliptin ít bị phân hủy, trong khi trong môi trường base nồng độ linagliptin giảm khoảng 25%. Linagliptin không bền với chất oxy hóa, với sự giảm nồng độ hơn 40% trong môi trường hydrogen peroxide 0,3%. Hoạt chất bị đổi màu nhẹ khi tiếp xúc với ánh sáng nhưng không tăng mức tạp chất chất liên quan. Một số tạp chất liên quan có thể xuất hiện trong quá trình tổng hợp hóa học linagliptin, bao gồm phản ứng aminolysis không hoàn toàn, sự thủy phân hay ngưng tụ của các tạp chất liên quan và sự chuyển hóa không hoàn toàn của các hợp chất trung gian. |
| Độ ổn định[3], [7] | Dạng bào chế của linagliptin tương đối ổn định dưới tác động của nhiệt độ, độ ẩm và ánh sáng. Sản phẩm không yêu cầu bất kỳ điều kiện bảo quản cụ thể nào.
Nhóm chức amino có thể tương tác với đường khử, nhóm carbonyl phản ứng hay gốc acid carboxylic tạo thành trên bề mặt MCC do quá trình oxy hóa. |
| Bảo quản | Bảo quản ở nhiệt độ không quá 30°C. |
4. Chuyên luận Dược Điển
|
Monograph |
Dược Điển |
| – | – |
5. Nhà sản xuất API
6. Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
(Chỉ dành cho tài khoản VIP)
6.1. Kinh nghiệm thực tế:
– Những lưu ý khi xây dựng công thức:
-
-
- Viên nén: Trong viên kết hợp với metfomin HCl, linagliptin hòa tan trong dung dịch dính và phun trực tiếp lên cốm, chứa metformin HCl. Nên loại bỏ gốc HCl bằng cách sấy metformin HCl để đảm bảo độ ổn định sản phẩm.
- Xây dựng viên nén kết hợp metformin và linagliptin, hàm lượng tá dược trơn bóng nên khảo sát kỹ để đạt tương đương sinh học với thuốc gốc.
-
6.2. Tài liệu cho xây dựng công thức
-
- Thuốc gốc: TRAJENTA dưới dạng viên nén bao phim với thành phần tá dược gồm mannitol, pregelatinised starch (maize), maize starch, copovidone (PVP), magnesium stearate, opadry pink 02F34337 (chứa hypromellose, titanium dioxide, talc, macrogol 6000, iron oxide red). Phương pháp sản xuất sản xuất là xát hạt ướt. Vì hàm lượng hoạt chất nhỏ, hoạt chất được nghiền mịn để đảm bảo đồng đều hàm lượng. Kích thước hoạt chất không ảnh hưởng đến độ hòa tan in vitro. Độ hòa tan của sản phẩm giảm dưới điều kiện độ ẩm cao. Vì vậy, cần sử dụng thêm túi hút ẩm với chai HDPE hay bao bì chống ẩm Al/Al để lưu hành thuốc.
- US 2018/0104249 A1: trình bày tổng quan các tá dược và phương pháp điều chế dạng bào chế rắn phối hợp giữa linagliptin và hoạt chất nhóm SGLT2i (dẫn xuất glucopyranosyl – substituted benzene). Do có nhóm amino bậc 1 và bậc 2 nên linagliptin tương kỵ với một số tá dược như MCC, natri starch glycolate, natri croscarmellose, acid tartaric, acid citric, glucose, fructose, saccharose,lactose và maltodextrin. Kích thước phân tử của linagliptin được đề cập D90 < 200 micro để đảm bảo độ hòa tan và đồng đều hàm lượng. Khảo sát kích thước hạt của các thành phần công thức, hàm lượng của hoạt chất và tá dược, nghiên cứu bào chế các dạng viên nén và đánh giá một số tính chất của viên tạo thành.[8]
- EP3156048: trình bày tổng quan các tá dược và phương pháp điều chế viên nén giải phóng nhanh chứa linagliptin bằng phương pháp xát hạt ướt/ dập thẳng. Patent sử dụng hỗn hợp hai dạng đa hình A và B của linagliptin, cho độ ổn định cao và cải thiện độ hòa tan cũng như sinh khả dụng. [9]
- US2019/0290588A1: trình bày tổng quan các tá dược, phương pháp điều chế viên nén hai lớp chứa empagliflozin và linagliptin. Khảo sát độ hòa tan, độ ổn định và các thay đổi về tạp chất của công thức. [10]
- Patent WO2017211979 xây dựng phương pháp sản xuất viên nén kết hợp linagliptin và metformin. L-arginine được sử dụng làm chất ổn định, một số tá dược khác gồm tinh bột bắp, copovidone, magnesium stearat và silicon dioxide.
Tài liệu tham khảo
[1] “DailyMed – TRADJENTA- linagliptin tablet, film coated.” https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=c797ea5c-cab7-494b-9044-27eba0cfe40f (accessed Sep. 15, 2022). [2] CHMP, “Committee for Medicinal Products for Human Use (CHMP) Assessment report,” 2016, Accessed: Sep. 15, 2022. [Online]. Available: www.ema.europa.eu/contact [3] “Assessment report Trajenta.” https://www.ema.europa.eu/en/documents/assessment-report/trajenta-epar-public-assessment-report_en.pdf (accessed Sep. 15, 2022). [4] “Linagliptin | C25H28N8O2 – PubChem.” https://pubchem.ncbi.nlm.nih.gov/compound/10096344#section=Clinical-Trials (accessed Sep. 15, 2022). [5] M. Attimarad, S. H. Nagaraja, B. E. Aldhubaib, A. Nair, and K. N. Venugopala, “Simultaneous determination of metformin and three gliptins in pharmaceutical formulations using RP HPLC: Application to stability studies on Linagliptin tablet formulation,” Indian J. Pharm. Educ. Res., vol. 48, no. 4, pp. 45–53, 2014, doi: 10.5530/IJPER.48.4.7. [6] Y. Huang, X. He, T. Wu, and F. Zhang, “Synthesis and Characterization of Process-Related Impurities of Antidiabetic Drug Linagliptin,” Mol. 2016, Vol. 21, Page 1041, vol. 21, no. 8, p. 1041, Aug. 2016, doi: 10.3390/MOLECULES21081041. [7] “STABLE BILAYER TABLET COMPOSITIONS – HETERO LABS LIMITED.” https://www.freepatentsonline.com/y2019/0290588.html (accessed Sep. 15, 2022). [8] “US 2018/0104249 A1.” https://patentimages.storage.googleapis.com/7b/2e/ea/bba2ef77e33855/US20180104249A1.pdf (accessed Sep. 15, 2022). [9] “EP 3 156 048 A1.” https://patentimages.storage.googleapis.com/af/8c/dc/2a91a686664bb2/EP3156048A1.pdf (accessed Sep. 15, 2022). [10] “STABLE BILAYER TABLET COMPOSITIONS.” https://www.freepatentsonline.com/20190290588.pdf (accessed Sep. 15, 2022).
