Desloratadin
Mục lục
1. Thông tin chung
| Tên dược chất [1] | Desloratadin |
| Cấu trúc | 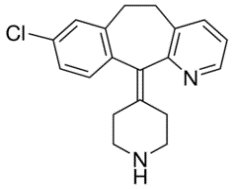 |
| Công thức cấu tạo | C19H19ClN2 |
| KLPT | 310.8 |
| Nhóm tác dụng dược lý | Antihistamin – OTC |
2.Biệt dược gốc và các dạng bào chế trên thị trường
2.1.Đơn chất
| STT | Dạng bào chế | Tên biệt dược |
| 1 | Viên nén | Clarinex |
| 2 | Viên nén bao phim | Aerius
Neoclarityn |
| 3 | Dung dịch | Clarinex
Aerius |
Dạng bào chế phổ biến tại Việt Nam: Viên nén bao phim, siro
2.2.Dạng phối hợp:
| STT | Hoạt chất phối hợp | Dạng bào chế | Tên biệt dược |
| 1 | Pseudoephedrine sulfate | Viên nén | Clarinex-D 12 hour |
3.Tính chất lý hóa
| Mô tả | Bột màu trắng hoặc gần như trắng |
| Tính tan | Khó tan trong nước, hơi tan trong ethanol, propylen glycol, acetonitril và toluen. Độ tan tăng trong môi trường acid.
Độ tan: 21.6 (µg/mL) |
| Độ tan (thực nghiệm) | N/A |
| BCS Class | I (tham khảo pharmacircle) |
| Nhiệt độ nóng chảy | 150oC |
| Tính hút ẩm | N/A |
| pKa | 9.7 |
| pH | N/A |
| Tính chất hóa học | Dược chất dễ trải qua quá trình oxi hóa và phân hủy bởi các tác nhân có tính acid, sinh một số tạp như N-formyl desloratadin, deschloro desloratadin, dihydro desloratadin.
Dược chất là amin bậc 2, có nguy cơ phản ứng với các đường khử (lactose…) theo phản ứng Maillard. |
| Độ ổn định | Dược chất có xu hướng sinh tạp chất, chuyển màu hồng nhạt khi tiếp xúc với các tác nhân có tính acid và/hoặc không khí ở điều kiện nhiệt độ và độ ẩm cao (40oC/75%RH).
Ở dạng dung dịch, dược chất ổn định nhất ở pH trong khoảng 5-6. |
4.Chuyên luận Dược Điển
| Monograph | Dược Điển |
| Desloratadine | USP, BP |
| Desloratadine Tablets | USP |
| Desloratadine Orally Disintegrating Tablets | USP |
5.Nhà sản xuất API
6.Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
Chỉ dành cho tài khoản VIP
6.1. Kinh nghiệm thực tế:
-
- Những lưu ý khi xây dựng công thức dung dịch thuốc:
- Dược chất khó tan trong nước, khó che được vị đắng của sản phẩm dung dịch uống. Nên cân nhắc lựa chọn chất tạo ngọt và hương phù hợp, hương thường được ưu tiên chọn là hương trái cây.
- Thành phẩm khi lưu độ ổn định sẽ có nguy cơ dược chất phân hủy, sinh tạp (hàm lượng nhỏ) và chuyển màu hồng nhạt. Do đó, có thể cân nhắc việc sử dụng tá dược màu (yellow, red hoặc phối hợp 2 màu) cho dung dịch để khắc phục vấn đề cảm quan của sản phẩm.
- Có thể cân nhắc chỉnh pH sản phẩm khoảng 5.0- 6.0 bằng việc sử dụng hệ đệm citric-citrat. Thêm EDTA làm tăng cường độ ổn định cho dung dịch.
- Những lưu ý khi xây dựng công thức viên nén (bao phim), viên ODT:
- Dược chất không ổn định với các tá dược có tính acid, nên cần lựa chọn hệ tá dược phù hợp. Có thể làm pre-formulation để xác định tương tác – tương kị giữa hoạt chất – tá dược. Hoặc tham khảo hệ tá dược thuốc gốc.
- Dược chất có hàm lượng nhỏ, nhạy cảm với ẩm, nên cân nhắc phương pháp bào chế để hạn chế tiếp xúc giữa dược chất và ẩm: tạo hạt khô, dập trực tiếp, tạo hạt với ethanol…
- Lựa chọn bao bì chống ẩm tốt để đảm bảo độ ổn định cho sản phẩm.
- Dược chất có vị đắng, nên khi làm viên ODT, cần sử dụng các tác nhân che đắng: betacyclodextrin, kyron, đường nhân tạo…
6.2. Tài liệu cho xây dựng công thức:
-
- Patent EP 2 568 970 B1 [3]: mô tả phương pháp bào chế viên nén bao phim chứa desloratadin 5mg bằng phương pháp dập trực tiếp và bao phim chống ẩm bằng opadry AMB. Patent cũng nêu ra một số tá dược có tương kị với desloratadin, cũng như một số tá dược không tương kị được sử dụng trong thử nghiệm.
- Patent US 6100274A [6]: mô tả phương pháp bào chế viên nén desloratadin 5mg bằng phương pháp tạo hạt ướt, sử dụng dicalci phosphat dihydrat làm chất ổn định. Patent cũng nêu ra phương pháp xác định tương kị giữa các tá dược với hoạt chất, cũng như nêu ra một số tá dược có tương kị với hoạt chất.6100274A
- Patent US 2012/0022094A1 (2012) [7]: mô tả phương pháp bào chế siro chứa desloratadin. Patent nêu ra hệ tá dược cho công thức, sử dụng hệ đệm citric-citrat để ổn định pH ở vùng 4.5 – 6.5 và EDTA để ổn định cho sản phẩm. Patent cũng nghiên cứu tới độ ổn định của các mẫu nghiên cứu.
Tài liệu tham khảo
-
- “Desloratadine | C19H19ClN2 – PubChem.” (accessed Jan. 08, 2022).
- [2] “Assessment report Desloratadine Actavis ,” 2011. Accessed: Jan. 08, 2022. [Online].
- I. • DÍEZ MARTÍN, E-08970 Sant Joan Despi (Barcelona) (ES), P. • PABLO ALBA, E-08970 Sant Joan Despi (Barcelona) (ES), C. • ÚBEDA PÉREZ, and E-08970 Sant Joan Despi (Barcelona) (ES), “STABLE PHARMACEUTICAL FORMULATIONS CONTAINING AN ANTIHISTAMINIC,” 2013.
- “Scentific Dicussion,” no. July, pp. 1–60, 2004, [Online].
- Mathivanan NatarajanSreekanth JoginapalliPraveen Reddy Billa, “Desloratadine-containing formulation stabilized with cyclodextrin,” Feb. 19, 2007.
- Jim H. Kou, “8-chloro-6,11-dihydro-11- ](4-piperidylidine)-5H-benzo[5,6]cyclohepta[1,2-bpyridine oral compositions ](4-piperidylidine)-5H-benzo[5,6]cyclohepta[1,2-bpyridine oral compositions,” Jul. 07, 1999.
- N. P. DAVID HARRIS, W. NJ (US); Farah J. Munayyer, and N. (US) Caldwell, “PHARMACEUTICAL FORMULATIONS,” 2012.
