Abiraterone Acetate
Mục lục
1. Thông tin chung
| Tên hoạt chất | ABIRATERONE ACETATE |
| Cấu trúc | 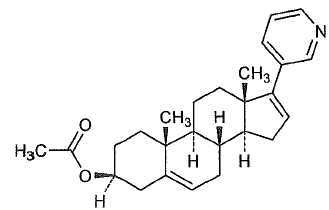 |
| CTPT | C26H33NO2 |
| KLPT | 391,55 |
| Nhóm dược lý | Chất ức chế sinh tổng hợp androgen |
2. Biệt dược gốc và các dạng bào chế trên thị trường
2.1. Đơn chất
| STT | Dạng bào chế | Tên biệt dược |
| 1 | Viên nén | Zytiga |
| 2 | Viên nén bao phim | Zytiga |
2.2. Dạng phối hợp
3. Tính chất lý hóa
| Tên họat chất | Abiraterone acetate |
| Mô tả [1] | Dạng tinh thể màu trắng hay trắng ngà. |
| Tính tan [1] | Không tan trong môi trường nước (pH từ 2,0-12,9), rất ít tan trong dung dịch HCl 0,1N và tan hoàn toàn trong các dung môi hữu cơ |
| Độ tan trong nước [1] | 0,00305 mg/mL. |
| BCS Class [1] | IV |
| Dạng đa hình [1] | Có nhiều dạng đa hình khác nhau, phụ thuộc vào điều kiện tổng hợp |
| Nhiệt độ nóng chảy [1] | 144 – 145 °C |
| Tính hút ẩm [1] | Không hút ẩm |
| Tính nhạy cảm với ánh sáng | Ổn định khi tiếp xúc với ánh sáng |
| pKa [1] | 5,19 (acid)
4,81 (base) |
| pH | 2 – 12.9 (EMA) |
| Tính chất hóa học [2] | Nhóm chức ester của Abiraterone acetate dễ bị thủy phân trong môi trường acid/base. Abiraterone acetate bền với nhiệt độ, ánh sáng và các chất oxi hóa. |
| Độ ổn định [3] | Abiraterone acetate trong viên nén bị oxid hóa khi thử nghiệm ở điều kiện lão hóa cấp tốc (40oC/75%RH). Vì vậy cần có các biện pháp chống oxi hóa phù hợp. |
| Bảo quản | Bảo quản ở nhiệt độ phòng 15-30oC, trong bao bì kín, tránh ánh sáng. |
4. Chuyên luận Dược Điển
| Monograph | Dược Điển |
| Abiraterone Acetate | USP |
| Abiraterone Acetate Tablets | USP |
5. Nhà sản xuất API
- Dr. Reddy’s Laboratories (Ấn Độ).
- ChemWerth Inc (USA)
- Transo-Pharm USA LLC (USA)
- NEWEDGE Overseas (Ấn Độ)
- Mac-chem Products (Ấn Độ)
- Teva API (Israel)
- Aurobindo Pharma Limited (Ấn Độ)
- Hetero Drugs (Ấn Độ)
6. Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
(Chỉ dành cho tài khoản VIP)
6.1. Kinh nghiệm thực tế
6.2. Tài liệu cho xây dựng công thức
Patent WO2014/009437 [3] đưa ra vấn đề Abiraterone acetate bị oxi hóa trong công thức viên nén khi thử nghiệm điều kiện lão hóa cấp tốc (40oC/75%). Các tác giả đã đưa ra một số phương án giải quyết vấn đề trên, bao gồm:
- Sử dụng các chất chống oxy hóa (BHT)
- Điều chỉnh pH của công thức (pH=3)
- Sử dụng màng bao phim chống thấm oxi
- Sử dụng bao bì chống oxy hóa và hút chân không.
Patent 3854384A1 [4] cải thiện độ hòa tan của Abiraterone acetate bằng hệ phân phối thuốc tự nhũ (Self-microemulsifyng drug delivery system (SEDDS)).
Patent CN103446069 [5] sử dụng Abiraterone acetate dạng micronized (kiểm soát kích thước hạt từ 0-20 micro) nhằm tăng độ hòa tan.
Patent CN109125276 [6] cải thiện độ hòa tan Abirateron acetate bằng công nghệ đùn ép nóng chảy. Hoạt chất được đùn ép nóng chảy với Copovidone tạo dạng phân tán rắn.
Patent CN108514550 [7] dùng công nghệ phun sấy tạo hạt, cải thiện độ hòa tan bằng Natri lauryl sulfate.
Nghiên cứu của Yuanfen Liu và cộng sự [8] cải thiện độ hòa tan trong viên nén Abiraterone acetate bằng công nghệ nano. Hoạt chất được nghiền ướt với Poloxamer bằng máy nghiền bi kiểu hành tinh. Kết quả cho thấy, độ hòa tan và sinh khả dụng của API được cải thiện đáng kể, tăng gấp 3,5 lần Cmax và 2,8 lần AUC so với thuốc gốc.
Tài liệu tham khảo
[1] “Formulation Diary.” https://formulationdiary.com/Home/Details/LURASIDONE%20HYDROCHLORIDE (accessed Sep. 23, 2022). [2] V. Bukkapatnam, M. A. Mukthinuthalapati, and K. C. Routhu, “Study on Stress Degradation Behaviour of Abiraterone Acetate in Film Coated Tablets and Identification of Major Stress Degradation Product by Liquid Chromatography-Ultraviolet-Electrospray Ionization-Mass Spectrometry,” Indian J Pharm Sci, vol. 84, no. 2, pp. 300–310, Apr. 2022, doi: 10.36468/PHARMACEUTICAL-SCIENCES.923. [3] “Oxidation stability of abiraterone acetate,” Jul. 2013. [4] “EP3854384A1 – Pharmaceutical formulation comprising abiraterone acetate – Google Patents.” https://patents.google.com/patent/EP3854384A1/en (accessed Sep. 23, 2022). [5] “CN103446069A – Oral solid composition of abiraterone and preparation method thereof – Google Patents.” https://patents.google.com/patent/CN103446069A/en (accessed Sep. 23, 2022). [6] “CN109125276 Abiraterone acetate tablet medicine composition and preparation method thereof.” https://patentscope.wipo.int/search/en/detail.jsf?docId=CN236275379&_cid=P10-L8BC5A-81262-1 (accessed Sep. 23, 2022). [7] “CN108514550 Solid drug containing abiraterone acetate and preparation method thereof.” https://patentscope.wipo.int/search/en/detail.jsf?docId=CN228745244&_cid=P10-L8BC5A-81262-2 (accessed Sep. 23, 2022). [8] Y. Liu, Y. Li, P. Xu, Y. Shen, B. Tang, and Q. Wang, “Development of Abiraterone Acetate Nanocrystal Tablets to Enhance Oral Bioavailability: Formulation Optimization, Characterization, In Vitro Dissolution and Pharmacokinetic Evaluation,” Pharmaceutics, vol. 14, no. 6, p. 1134, Jun. 2022, doi: 10.3390/PHARMACEUTICS14061134/S1.
