Telmisartan
Mục lục
1. Thông tin chung [1]
| Tên hoạt chất | Telmisartan |
| Cấu trúc | 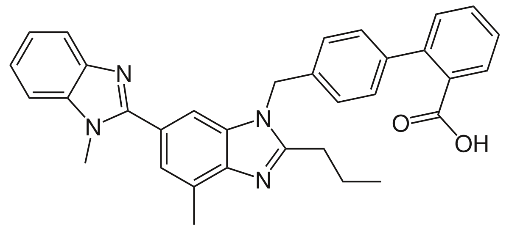 |
| CTPT | C33H30N4O2 |
| KLPT | 514.6 |
| Nhóm dược lý | Thuốc trị tăng huyết áp – ETC |
2. Biệt dược gốc và các dạng bào chế trên thị trường [2]
2.1. Đơn chất
| STT | Dạng bào chế | Tên biệt dược |
| 1 | Viên nén | Micardis |
| 2 | Viên nén | Pritor |
- Dạng bào chế phổ biến tại Việt Nam: viên nén.
2.2. Dạng phối hợp
3. Tính chất lý hóa
| Tên họat chất | Telmisartan |
| Mô tả [3] | Bột kết tinh màu trắng đến vàng nhạt.
Có hiện tượng đa hình (polymorphism). |
| Tính tan [3], [4] | Tan tự do trong acid formic, ít tan trong methanol và ethanol, thực tế không tan trong nước.
Tan ít trong acid mạnh, không tan trong HCl, tan trong base mạnh. |
| Độ tan trong nước | Thực tế không tan trong nước. Độ tan ước tính 2,8×10-6 mg/L ở 25°C. |
| BCS Class | II |
| Dạng đa hình [4] | Tinh thể telmisartan tồn tại ở hai dạng đa hình có nhiệt độ nóng chảy khác nhau. Dưới ảnh hưởng của độ ẩm và nhiệt độ, dạng đa hình B (có nhiệt độ nóng chảy thấp hơn) chuyển đổi không thuận nghịch thành dạng đa hình A. Cả hai dạng đa hình đều kém hòa tan trong nước ở pH 1-7. |
| Nhiệt độ nóng chảy | 261-263 °C |
| Tính hút ẩm [5] | Dạng muối của telmisartan với kiềm có tính hút ẩm cao. |
| Tính nhạy cảm với ánh sáng | Hoạt chất telmisartan bị phân hủy nhẹ bởi tia UV trong thử nghiệm stress test. Tuy nhiên dạng bào chế viên nén bao phim không nhạy cảm với ánh sáng. |
| pKa | pKa (acid mạnh nhất): 3,62
pKa (base mạnh nhất): 5,86 |
| pH | N/A |
| Tính chất hóa học [6], [7] | Telmisartan bị phân hủy sau 5h trong hầu hết các thử nghiệm stress test. Trong quá trình tổng hợp hóa học telmisartan cũng có thể sinh ra các tạp quá trình. Telmisartan có tính phân cực, có các nhóm chức amin có thể tương tác mạnh với các nhóm hydroxyl. |
| Độ ổn định [8] [9] | Telmisartan ổn định trong điều kiện môi trường bình thường. Telmisartan cho thấy sự thay đổi màu nhẹ trong thử nghiệm chiếu xạ với đèn xenon, do đó telmisartan nên được bảo vệ tránh ánh sáng trực tiếp.
Telmisartan ổn định trong môi trường kiềm, phân hủy trong môi trường acid. |
| Bảo quản | Bảo quản ở nhiệt độ phòng trong bao bì kín, tránh ánh sáng. |
4. Chuyên luận Dược Điển
| Monograph | Dược Điển |
| Telmisartan | JP, BP, USP, EP, IP |
| Telmisartan Tablets | JP, USP, EP, IP |
| Telmisartan and Hydrochlorothiazide Tablets | JP, USP |
| Telmisartan and Amlodipine Tablets | USP |
5. Nhà sản xuất API
- Verdant Life Sciences PVT.LTD. (Ấn Độ)
- Glenmark Life Sciences Limited (Ấn Độ)
- Hetero Labs Limited (Ấn Độ)
- Moehs Catalana, S.L (Tây Ban Nha)
6. Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
Chỉ dành cho tài khoản VIP
6.1. Kinh nghiệm thực tế:
- Viên nén: Telmisartan dạng muối với kiềm có tính hút ẩm cao, dễ khiến viên bị chảy hay bị dính. [5]. Vì vậy nên lựa chọn bao bì chống ẩm phù hợp.
- Công thức viên nén chứa Telmisartan thường kết hợp với tá dược kiểm meglumin để ổn định hoạt chất.
- Thuốc gốc Micardis bào chế bằng phương pháp sấy phun dung dịch gồm hoạt chất, tá dược dính và tá dược ổn định. Sau đó, trộn với sorbitol và magnesi stearat. Tuy nhiên, có thể thay thế bằng phương pháp phun sấy tạo hạt dung dịch hoạt chất và tá dược dính lên sorbitol. Có thể thay thế sorbitol thành mannitol để giảm tính dính bết của sorbitol trong quá trình phun sấy.
6.2. Tài liệu cho xây dựng công thức
- Thuốc gốc: Micardis (40mg) thành phần tá dược gồm natri hydroxid – 3,36mg [tá dược trợ tan], polyvidone (collidone 25) – 12 mg [tá dược dính], meglumine – 12mg [tá dược trợ tan], sorbitol – 168,64 mg [tá dược độn], magie stearat – 4mg [tá dược trơn bóng].
- Patent US 2011/0189295 A1 mô tả phương pháp điều chế viên nén telmisartan với thành phần tá dược bao gồm: natri hydroxid, polyvidone, sorbitol, meglumine, magie stearat bằng phương pháp xát hạt ướt. Telmisartan được sử dụng dưới dạng muối tạo với base hữu cơ hay vô cơ như meglumine/ NaOH hay KOH. [10]
- Patent WO2006063737 mô tả phương pháp điều chế viên nén hai lớp chứa telmisartan và hydrochlorothiazide. Lớp viên chứa telmisartan được tạo thành bằng phương pháp sấy phun dung dịch telmisartan trong base, trộn với tá dược độn và tá dược trơn bóng sau đó dập viên. Lớp thứ hai chứa hydrochlorothiazide được tạo thành bằng phương pháp xát hạt ướt. [11]
- Patent US20060110450 mô tả phương pháp điều chế viên nén hai lớp chứa telmisartan và amlodipin. Cấu trúc hai lớp khắc phục được vấn đề về độ ổn định do sự không tương thích của amlodipine với các thành phần base trong công thức của lớp chứa telmisartan. [12]
- Nghiên cứu của S. Swati và cộng sự: xây dựng công thức và quy trình điều chế viên nén giải phóng tức thời chứa telmisartan sử dụng các polymer thân nước. Nghiên cứu tiến hành điều chế hệ phân tán rắn với các tỷ lệ polymer khác nhau, tiến hành điều chế viên nén và đánh giá hàm lượng hoạt chất, khả năng giải phóng hoạt chất cũng như tương tác giữa hoạt chất – polymer sử dụng quang phổ FTIR. [13]
