Salbutamol
Mục lục
1. Thông tin chung
|
Tên hoạt chất |
Salbutamol [1] |
Salbutamol sulfat [2] |
| Cấu trúc | 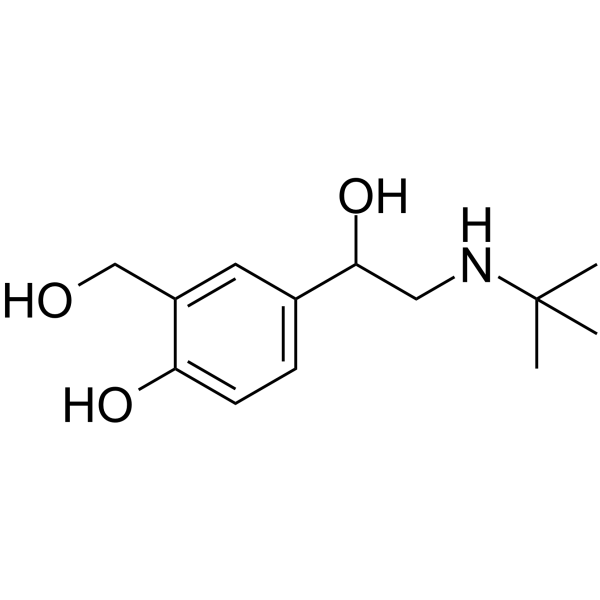 |
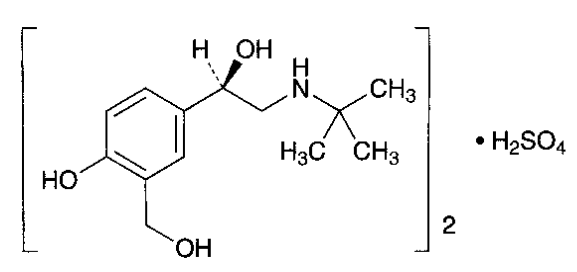 |
| Công thức phân tử | C13H21NO3 | (C13H21NO3)2. H2SO4 |
| KLPT | 239,3 | 576,7 |
| Hệ số chuyển đổi | 1g salbutamol sulfat tương ứng với 0,83 g salbutamol | |
| Nhóm tác dụng dược lý | Chủ vận beta-2 (ETC) | Chủ vận beta-2 (ETC) |
2. Biệt dược gốc và các dạng bào chế trên thị trường
2.1. Đơn chất
2.2. Dạng phối hợp
| STT | Hoạt chất | Dạng bào chế | Tên biệt dược |
| 1 | Ipratropium bromide monohydrate | Khí dung | Combivent |
3. Tính chất lý hóa
| Salbutamol | Salbutamol sulfat | |
| Mô tả | Bột tinh thể trắng hay gần như trắng. | Bột kết tinh trắng hay gần như trắng |
| Tính tan | Ít tan tan trong nước, tan được trong ethanol 96% [3] | Ít tan trong nước, thực tế không tan hoặc rất khó tan trong ethanol 96% và trong methylen clorid [4] |
| Độ tan (thực nghiệm) | N/A | 14,1 g/L |
| BCS Class | III [5] | N/A |
| Nhiệt độ nóng chảy | 155 °C kèm theo phân hủy | NA |
| Tính hút ẩm | N/A | Salbutamol sulfat có tính hút ẩm đáng kể [6] |
| pKa | pKa1 = 9,3
pKa2= 10,3 |
N/A |
| pH | N/A | N/A |
| Tính chất hóa học | Trong dung dịch cồn, salbutamol phân hủy tạo salbutamol ethyl ether và diethyl ether. Cơ chế được cho là do sự khử nước của rượu dưới xúc tác acid. Môi tường pH thấp thúc đẩy sự phân hủy của salbutamol [7]
Trong dung dịch methanol với pH kiềm (đun nóng) các gốc OH alcol của salbutamol tách nước tạo ether (tạp A, F) [8] |
Dược chất dễ bị phân hủy dưới ảnh hưởng của ánh sáng, tác nhân oxi hóa, tác nhân kiềm dẫn tới sự thay đổi màu (và xuất hiện kết tủa khi pha dạng thuốc lỏng). |
| Độ ổn định | N/A | Dung dịch salbutamol trong nước ổn định nhất ở pH khoảng 3,5. Thiourea có thể sử dụng như chất chống oxy hóa trong dung dịch hay khí dung [9]. Bảo quản dung dịch tránh ánh sáng, tránh tác nhân kiềm. |
4. Chuyên luận Dược Điển
5. Nhà sản xuất API
6. Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
Chỉ dành cho tài khoản VIP
6.1. Kinh nghiệm thực tế:
Những lưu ý khi xây dựng công thức siro:
-
- pH đóng vai trò quan trọng trong quá trình tạo ra tạp nên cần cân nhắc theo dõi và trong khoảng cho phép trong giới hạn của dược điển
- API khi bị phân hủy sẽ gây thay đổi màu thành vàng tới nâu đỏ và chứa tủa nên có thể sử dụng cảm quan để sàng lọc công thức.
- Sử dụng bao bì tránh ánh sáng truyền qua.
6.2. Tài liệu cho xây dựng công thức
-
- Patent WO 2014/191414 Al [10]: Mô tả phương pháp bào chế salbutamol dưới dạng siro uống. Patent này sử dụng HPMC là chất làm tạo nhớt, chất làm ngọt: sodium saccharin và chất bảo quản: sodium benzoat.
- Patent CN112022819 [11]: Mô tả công thức và phương pháp bào chế viên nén salbutamol sulfat. Thành phần viên nén gồm 0,5-5% salbutamol sulfat; 0,5-2% tá dược trơn bóng, 10-65% tá dược độn; 25% chất tạo độ rã, 10-30% beta-cyclodextrin; 0,5-5% chất chống oxy hóa như vitamin C; L-cystein hay sodium thiosulfat.
Tài liệu tham khảo
[1] “Salbutamol | C13H21NO3 – PubChem.” (accessed Mar. 15, 2022).
[2] “Albuterol sulfate | C26H44N2O10S – PubChem.” (accessed Mar. 15, 2022).
[3] E. Pharmacopoeia, D. Fatty, T. Ii, A. Identification, and T. Acid, “SAFFLOWER OIL , REFINED Carthami oleum raffinatum SALBUTAMOL,” no. 1, pp. 2879–2881, 2010.
[4] a R. Och, R. Ch, and O. H. Rs, “SALBUTAMOL SULPHATE Salbutamoli sulfas,” no. 3, pp. 4–6, 2005.
[5] “BCS Database results – Salbutamol.”
[6] N. Davidson et al., “Measurement of the Raman spectra and hygroscopicity of four pharmaceutical aerosols as they travel from pressurised metered dose inhalers (pMDI) to a model lung,” Int. J. Pharm., vol. 520, no. 1–2, pp. 59–69, Mar. 2017, doi: 10.1016/J.IJPHARM.2017.01.051.
[7] M. Cope and F. Bautista-Parra, “The degradation of salbutamol in ethanolic solutions,” J. Pharm. Biomed. Anal., vol. 52, no. 2, pp. 210–215, Jun. 2010, doi: 10.1016/J.JPBA.2010.01.003.
[8] Y. K. Sharma, D. D. Agarwal, S. Bhure, R. N. Mukharjee, P. K. Sahu, and S. Bhardwaj, “Synthesis, isolation and characterization of process-related impurities in salbutamol sulphate,” E-Journal Chem., vol. 8, no. 4, pp. 1720–1727, 2011, doi: 10.1155/2011/230231.
[9] L. Mälkki and S. Tammilehto, “Decomposition of salbutamol in aqueous solutions. I. The effect of pH, temperature and drug concentration,” Int. J. Pharm., vol. 63, no. 1, pp. 17–22, Aug. 1990, doi: 10.1016/0378-5173(90)90095-L.
[10] “2) INTERNATIONAL APPLICATION PUBLISHED UNDER THE PATENT COOPERATION TREATY (PCT,” 2014.
[11] “CN112022819 Salbutamol sulfate tablets and preparation method thereof.” (accessed Mar. 15, 2022).
