Loratadin
Mục lục
1. Thông tin chung
| Tên hoạt chất | Loratadin |
| Cấu trúc | 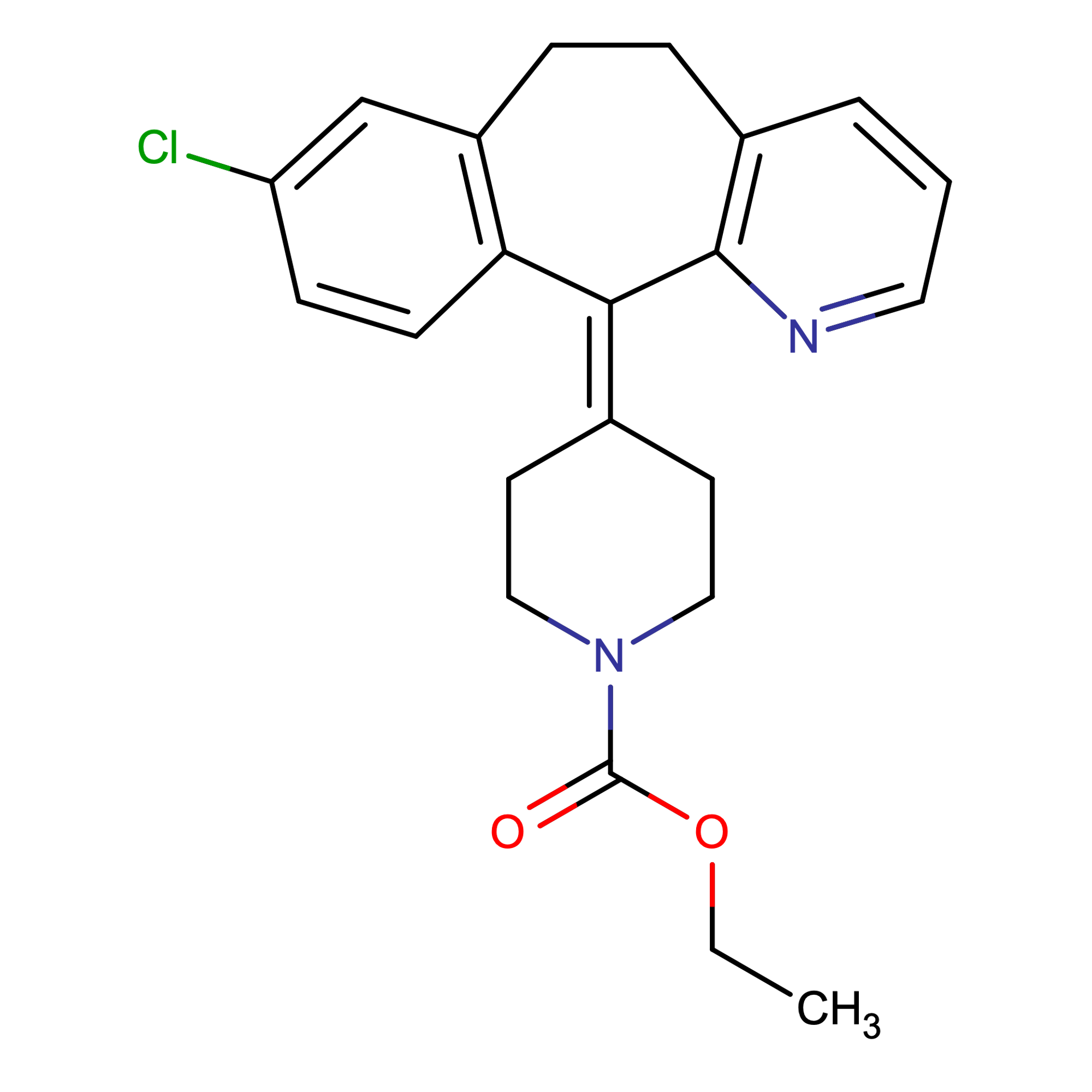 |
| CTPT | C22H23ClN2O2 |
| KLPT | 382,88 |
| Nhóm dược lý | Thuốc kháng Histamin – OTC |
2. Biệt dược gốc và các dạng bào chế trên thị trường
2.1. Đơn chất
| STT | Dạng bào chế | Tên biệt dược |
| 1 | Viên nén phân tán | Claritin Reditabs |
| 2 | Viên nén | Claritin |
| 3 | Siro | Children’s Claritin Syrup |
| 4 | Viên nhai | Children’s Claritin Chewables |
| 5 | Viên nang mềm | Claritin Liqui-Gels Capsules |
Dạng bào chế phổ biến tại Việt Nam: viên nén bao phim, viên nén phân tán và siro.
2.2. Dạng phối hợp
| STT | Hoạt chất phối hợp | Dạng bào chế | Tên biệt dược |
| 1 | Pseudoephedrine sulfate | Viên nén phóng thích kéo dài | Claritin-D 24h |
| 2 | Paracetamol, Dextromethorphan HBr, Phenylephrin HCl | Viên nén bao phim | Glotadol F |
| 3 | Paracetamol, Dextromethorphan HBr | Viên nén bao phim | Biviflu |
3. Tính chất lý hóa
| Tên họat chất [2] | Loratadin |
| Mô tả | Bột tinh thể màu trắng hoặc gần trắng, vị đắng.
Có hiện tượng đa hình polymorphism. |
| Tính tan | Tan hoàn trong acetone và methanol và ít tan trong nước. |
| Độ tan trong nước | <1 mg/ml.
Độ tan phụ thuộc vào môi trường pH. Trong môi trường acid, loratadin có độ tan tốt hơn [3]. |
| BCS Class | II |
| Nhiệt độ nóng chảy | 134 – 136 °C |
| Tính hút ẩm | Ít hút ẩm |
| pKa | 4,33 |
| pH | N/A |
| Tính chất hóa học | Trong dung dịch, loratadine có xu hướng phân huỷ thành tạp 2-hydroxymethyl loratadin và 4-hydroxymethyl loratadin và các tạp liên quan khác [4].
Loratadin không bền trong điều kiện nhiệt độ, độ ẩm, nhất là ánh sáng, oxi không khí và tác nhân oxi hoá. |
| Độ ổn định | dạng bào chế của loratadin dễ giảm hàm lượng và phát sinh tạp chất, cần có biện pháp cải thiện độ ổn định (như sử dụng tá dược, bao bì chống ẩm, chống ánh sáng…). |
| Bảo quản | Bảo quản ở nhiệt độ phòng, trong bao bì kín, tránh ánh sáng. |
4. Chuyên luận Dược Điển
| Monograph | Dược Điển |
| Loratadin | USP, EP, BP |
| Loratadin Tablets | USP, BP |
| Loratadin for Orally Disintegrating Tablets | USP |
| Loratadin Oral Solution | USP |
| Loratadin Chewable Tablets | USP |
| Loratadin Capsules | USP |
5. Nhà sản xuất API
-
- Morepen Laboratories Limited (Ấn Độ)
- Cadila Pharmaceuticals Ltd (Ấn Độ).
- Vasudha Pharma Chem Limited (Ấn Độ)
6. Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
Chỉ dành cho tài khoản VIP
Kinh nghiệm thực tế
Những lưu ý khi xây dựng công thức:
-
- Siro: Loratadin khó tan trong nước, cần khảo sát các dung môi thích hợp.
- Viên nén: Loratadin không bền, dễ sinh tạp chất nên cần khảo sát các chất ổn định và khảo sát tính tương kỵ với các tá dược sử dụng.
Tài liệu cho xây dựng công thức
-
- Patent US20070286875A1 Click or tap here to enter text.: trình bày tổng quan các tá dược và phương pháp bào chế siro loratadin. Trên cơ sở đó, tiến hành thực nghiệm khảo sát và đánh giá ảnh hưởng của các chất ổn định, các thành phần mùi hương, các thông số khi đóng chai lên nguy cơ phát sinh tạp chất của thành phẩm siro loratadin khi theo dõi độ ổn định trong điều kiện lão hoá cấp tốc.
- Patent EP1082117B1 [4]: trình bày tổng quan các tá dược và khảo sát các chất ổn định dùng để xây dựng công thức siro loratadin. Đề xuất một số công thức và phương pháp bào chế siro loratadin.
- Nghiên cứu của Biswajit Bunia và cs (2015) [6]: xây dựng công thức, đánh giá và kiểm soát các thông số của quy trình bào chế viên nén phân tán loratadin. Nghiên cứu tiến hành khảo sát hiện tương đa hình của loratadin, sàng lọc tính tương kỵ giữa dược chất – tá dược, đánh giá các nguy cơ trong quy trình sản xuất lên tính chất của thành phẩm và nghiên cứu tương tương đương in vitro. Tiếp theo, tiến hành nghiên cứu tối ưu hoá công thức và đánh giá ảnh hưởng của các thông số trọng yếu của quy trình lên tính chất thành phẩm.
- Viên nén Loratadin Patent EP0973527B1 [7]: khảo sát công thức viên bao phim clarithromycin 500 mg có tác dụng phóng thích kéo dài và giảm hậu vị. Nghiên cứu sinh khả dụng và chứng minh tương đương sinh học với biệt dược Biaxin.
- Nghiên cứu của Jayadev Patil và cs (2012) [8]: khảo sát tính tương kỵ loratadin và các tá dược. Trên cơ sở đó, tiến hành bào chế viên nén nhai loratadin bằng phương pháp xát hạt ướt và so sánh độ hoà tan của các công thức.
- Nghiên cứu của K. Kathiresan và cs (2010) [9]: khảo sát tính tương kỵ loratadin và tá dược. Trên cơ sở đó, tiến hành khảo sát thành phần viên nén nhai loratadin bằng phương pháp dập trực tiếp và so sánh độ hoà tan với thuốc đối chứng Claritin. Công thức tương đương độ hoà tan được nghiên cứu độ ổn định trong điều kiện thường và điều kiện lão hoá cấp tốc
Tài liệu tham khảo
[1] “Loratadine | C22H23ClN2O2 – PubChem.” (accessed Mar. 12, 2022). [2] “Loratadine: Uses, Interactions, Mechanism of Action | DrugBank Online.” (accessed Mar. 12, 2022). [3] M. Z. I. Khan et al., “Classification of loratadine based on the biopharmaceutics drug classification concept and possible in vitro-in vivo correlation,” Biological & pharmaceutical bulletin, vol. 27, no. 10, pp. 1630–1635, Oct. 2004, doi: 10.1248/BPB.27.1630. [4] “EP1082117B1 – A stabilized antihistamine syrup containing aminopolycarboxylic acid as stabilizer – Google Patents.” (accessed Mar. 10, 2022). [5] “US20070286875A1 – Oral liquid loratadine formulations and methods – Google Patents.” (accessed Mar. 10, 2022). [6] “Innovations in Pharmaceuticals and Pharmacotherapy – IPP.” (accessed Mar. 10, 2022). [7] “EP0973527B1 – Extended release formulations of clarithromycin – Google Patents.” (accessed Mar. 04, 2022). [8] A. Faridh Ridwan and J. Patil, “Formulation development and evaluation of chewable tablets containing non-sedating antihistamine,” JPSI, vol. 1, no. 3, pp. 112–117, Accessed: Mar. 15, 2022. [Online]. Available: www.jpsionline.com [9] K. Kathiresan, C. Moorthi, and R. Manavalan, “Formulation and evaluation of loratadine chewable tablets,” no. 4, pp. 975–8585.
