Gabapentin
Mục lục
1. Thông tin chung
| Tên dược chất
Thông số |
Gabapentin | Gabapentin enacarbil |
| Cấu trúc | 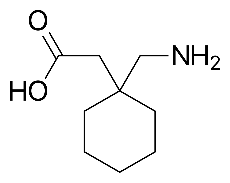 |
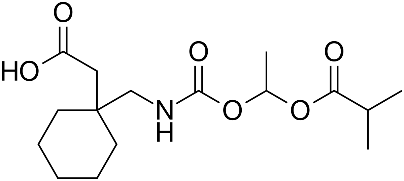 |
| Công thức cấu tạo | C9H17NO2 | C16H27NO6 |
| KLPT | 171.24 | 329.39 |
| Nhóm tác dụng dược lý | Thuốc chống động kinh – ETC | |
2.Biệt dược gốc và các dạng bào chế trên thị trường
2.1.Đơn chất
| STT | Dạng bào chế | Tên biệt dược |
| 1 | Viên nang cứng | Neurontin |
| 2 | Viên nén bao phim | Neurontin |
| 3 | Dung dịch uống | Neurontin |
| 4 | Viên nén phóng thích kéo dài | Horizant |
Dạng bào chế phổ biến tại Việt Nam: viên nang cứng và viên nén bao phim
2.2.Dạng phối hợp:
Các dạng phối hợp với cannabidiol, trazodone hoặc ketoprofen lysine đều đang trong giai đoạn thử nghiệm lâm sàng, chưa được bán trên thị trường
3.Tính chất lý hóa
| Gabapentin | Gabapentin enacarbil | |
| Mô tả | Tinh thể màu trắng đến trắng ngà | Tinh thể màu trắng đến trắng ngà |
| Tính tan | Dễ tan trong nước, dung dịch acid và base | Rất khó tan trong nước |
| Độ tan (thực nghiệm) | N/A | Độ tan 0.5 mg/ml trong nước và 10.2 mg/ml trong đệm phosphat (pH 6.3) |
| BCS Class | III | II |
| Dạng đa hình | Có thể tồn tại ở dạng tinh thể form I, II, III, IV. Trong đó form II là ổn định nhất (dạng được thương mại hóa) | N/A |
| Nhiệt độ nóng chảy | 162-166 oC | Khoảng 64 oC |
| Tính hút ẩm | Không đáng kể | Không đáng kể |
| pKa | pKa1 = 3.68 (carboxylic acid); pKa2 = 10.70 (amin) ở 25 °C | pKa 5.0 |
| pH | 6.5 – 8.0 (20 mg/ml trong nước) | N/A |
| Tính chất hóa học | Dược chất xảy ra quá trình đóng vòng nội phân tử tạo thành gabapentin lactam là một chất độc được quy định giới hạn (<0,5%) trong chuyên luận dược điển. Quá trình xảy ra một cách tự nhiên cả ở trạng thái rắn hay trong dung dịch và phụ thuộc vào pH, nhiệt độ | N/A |
| Độ ổn định | Dạng bào chế chứa Gabapentin thường khá ổn định. Hạn sử dụng thành phẩm từ 24-36 tháng. | N/A |
4.Chuyên luận Dược Điển
| Monograph | Dược Điển |
| Gabapentin | USP, BP, EP |
| Gabapentin capsules | USP, BP |
| Gabapentin tablets | USP, BP |
| Gabapentin oral solution | BP |
5.Nhà sản xuất API
-
- Zhejiang Chiral Medicine Chemicals Co.,Ltd (China)
- Vardhman Chemtech Limited (India)
- Divi’s Laboratories Limited (India)
- Supriya Lifescience Ltd (India)
6.Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
Chỉ dành cho tài khoản VIP
6.1. Kinh nghiệm thực tế:
-
- Những lưu ý khi xây dựng công thức viên nang:
- Để giảm giảm quá trình sinh tạp của dược chất, nên sử dụng các tá dược có hàm lượng acid vô cô thấp (<20 ppm). Một số tá dược được cho là tương kỵ với Gabapentin bao gồm: tinh bột bắp biến tính, natri croscarmellose, ester của glycerol behenic acid, methacrylic acid co-polymers (types A and C), các chất trao đổi anion, titanium dioxide và silica gels như Aerosil 200. Lactose có thể phản ứng Maillard với Gabapentin
- Đối với quy trình trộn trực tiếp đóng nang với vít phân liều, dược chất gabapentin tương đối bết có thể dẫn đến không đồng đều khối lượng khi đóng nang, có thể sử dụng talc để làm tăng tỉ trọng khối bột, độ chảy và chống dính trong quá trình đóng nang
- Những lưu ý khi xây dựng công thức viên nén bao phim: N/A
- Những lưu ý khi xây dựng công thức dung dịch uống: N/A
6.2. Tài liệu cho xây dựng công thức:
-
- In Re Gabapentin Patent Litigation, 395 F. Supp. 2d 140 (D.N.J. 2005) và tóm tắt sản phẩm Gabapentin Sandoz [8], [9]
- Mô tả thành phần hỗn hợp bột trong nang bao gồm: 74,07% gabapentin, 20% talc được dùng như là một chất giúp chảy tốt và chống dính, 5,93% Starch 1500 hoặc pregelatinized starch dùng như tá dược rã
- Mô tả thành phần cho viên nén bao phim gabapentin bao gồm: 70,9% gabapentin API; 4,4% povidone; 15,9% microcrystalline cellulose; 1,4% crospovidone; 2% talc; 2,9% hydrogenated vegetable oil; 2,5% Opadry® Y-1 7000H white; alcohol
- Patent EP1715894A2 (2006) [10]
- Mô tả thành phần viên nang cứng gabapentin với hệ tá dược được cho là ít ảnh hưởng đến độ ổn định của dược chất như là microcrystallin cellulose; magnesium stearat và sodium lauryl sulphat
Tài liệu tham khảo
-
- “National Center for Biotechnology Information (2021). PubChem Compound Summary for CID 3446, Gabapentin.”
- “National Center for Biotechnology Information (2021). PubChem Compound Summary for CID 9883933, Gabapentin enacarbil.”
- FDA, “Prescribing information Neurontin (Gabapentin),” 2020.
- H. Of et al., “INDICATIONS AND USAGE HORIZANT TM ( gabapentin enacarbil ) Extended-Release Tablets are indicated for the treatment of moderate-to-severe primary Restless Legs Syndrome ( RLS ) in adults . HORIZANT is not recommended for patients who are required to sleep ,” pp. 1–20, 2011.
- “Gabapentin Monograph,” in USP43, .
- Z. Zong and L. E. Kirsch, “Studies on the mechanisms of solid state and solution instability of drugs,” vol. 3494132, p. 133, 2011, [Online].
- “Public Assessment Report Scientific discussion levobupivacain,” no. February, pp. 9–12, 2014, [Online]. Available: http://mri.cts-mrp.eu/download/NL_H_2881_001_PAR.pdf.
- “In re GABAPENTIN PATENT LITIGATION.” https://www.courtlistener.com/opinion/2427939/in-re-gabapentin-patent-litigation/.
- T. Sandoz, “of the Medicines Evaluation Board in the Netherlands Sandoz B . V ., the Netherlands,” vol. 10, no. 1, pp. 1–12, 2009.
- “WO2005072736A2.pdf.” .
