Clarithromycin
Mục lục
1. Thông tin chung
| Tên hoạt chất [1] | Clarithromycin | Clarithromycin citrate |
| Cấu trúc | 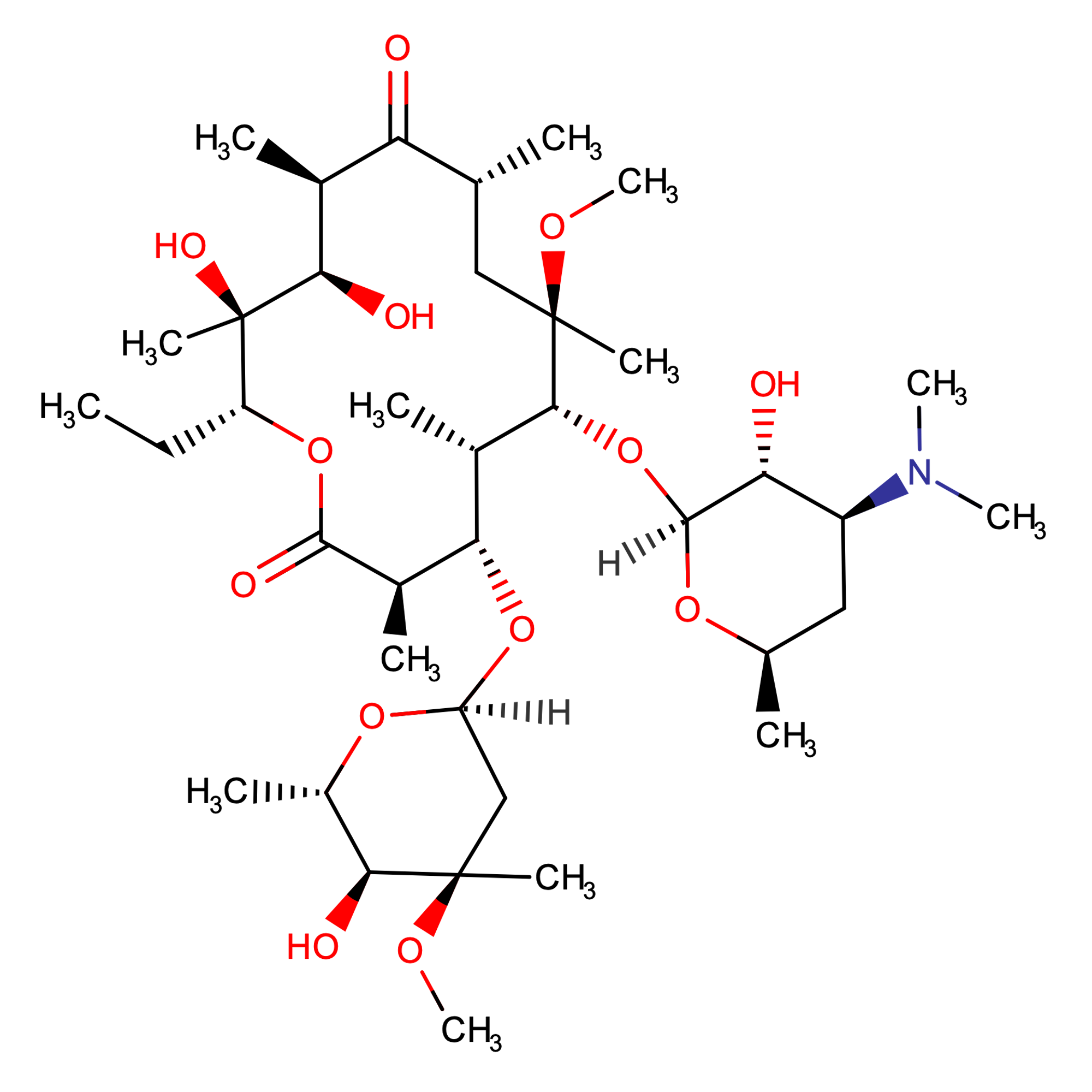 |
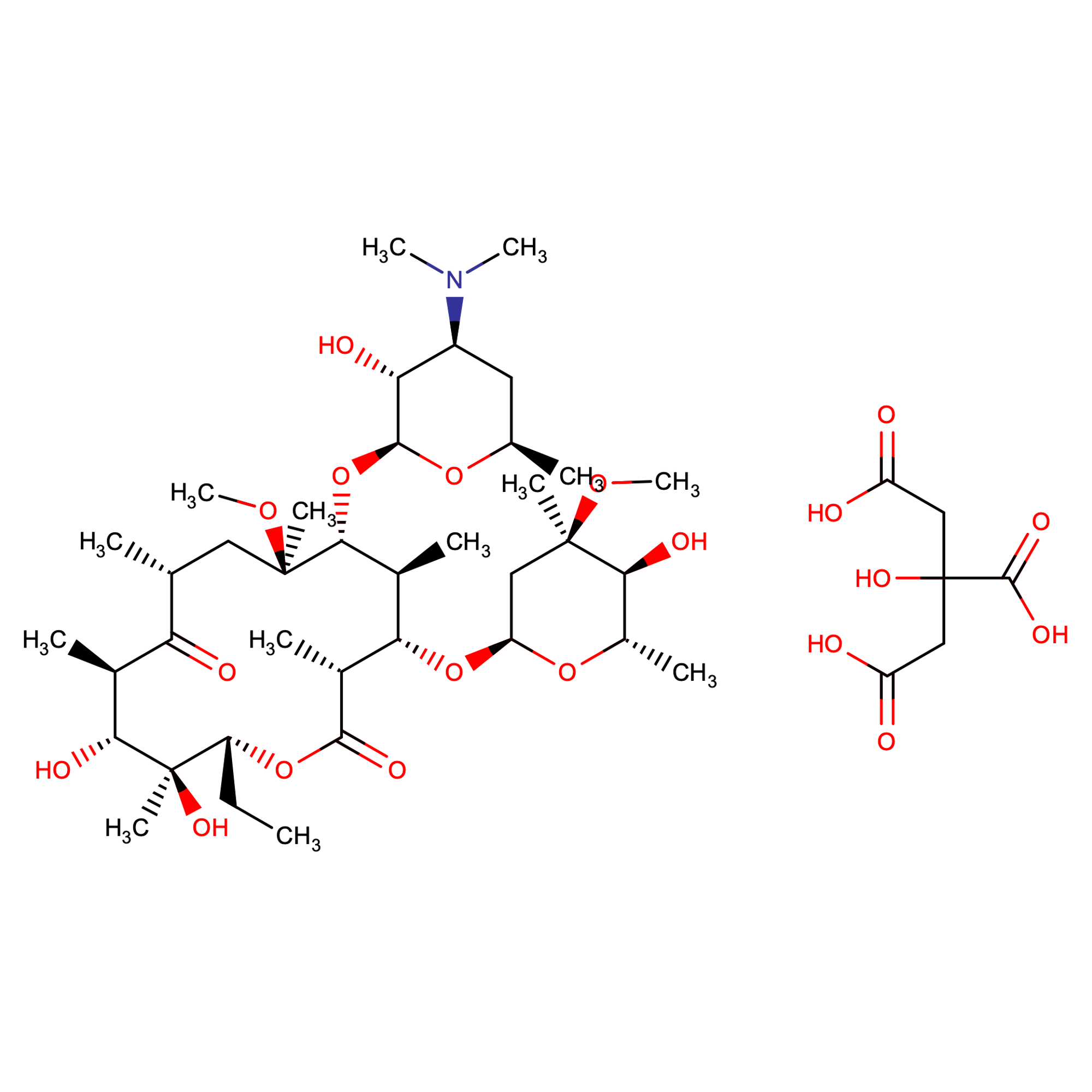 |
| CTPT | C38H69NO13 | C44H77NO20 |
| KLPT | 747,95 | 940.087 |
| Nhóm dược lý | Kháng sinh – ETC | |
2. Biệt dược gốc và các dạng bào chế trên thị trường
2.1. Đơn chất
| STT | Dạng bào chế | Tên biệt dược |
| 1 | Viên nén bao phim | Klacid |
| 2 | Viên nén phóng thích kéo dài | Klacid MR |
| 3 | Thuốc cốm pha hỗn dịch | Klacid |
Dạng bào chế phổ biến tại Việt Nam: viên nén bao phim và thuốc cốm pha hỗn dịch.
2.2. Dạng phối hợp
| STT | Hoạt chất phối hợp cùng vỉ | Dạng bào chế | Tên biệt dược |
| 1 | Tinidazol, Esomeprazol | Viên nén bao phim, viên nang cứng | E-Xazol |
| 2 | Metronidazol, Omeprazol | Viên nén bao phim, Viên nang cứng | Antipylo |
| 3 | Lansoprazol, Tinidazazol | Viên nén bao phim, viên nang | Melankit |
3. Tính chất lý hóa
| Tên họat chất | Clarithromycin |
| Mô tả | Bột tinh thể màu trắng hoặc gần trắng, vị đắng. |
| Tính tan | Tan trong acetone, tan ít (slightly soluble) trong methanol, ethanol, acetonitrile và gần như không tan trong nước. |
| Độ tan trong nước | 0,33 mg/L
Độ tan càng giảm khi môi trường pH càng tăng. Môi trường pH 4,5 có độ tan lớn hơn môi trường pH 6,8 và độ tan không thay đổi khi pH > 9 [2]. |
| BCS Class | II |
| Nhiệt độ nóng chảy | 220 °C |
| Tính hút ẩm | N/A |
| pKa | 8,99 |
| pH | N/A |
| Tính chất hóa học | Môi trường pH acid (pH < 3) thì dược chất tan tốt nhưng kém ổn định và bị phân huỷ thành decladinosyl-clarithromycin [3]. Môi trường pH càng tăng, sẽ ổn định nhưng độ tan kém nên sinh khả dụng thấp. |
| Độ ổn định | N/A |
| Bảo quản | Bảo quản ở nhiệt độ phòng, trong bao bì kín, tránh ánh sáng. |
4. Chuyên luận Dược Điển
| Monograph | Dược Điển |
| Clarithromycin | USP, EP, BP |
| Clarithromycin Tablets | USP, BP |
| Clarithromycin for Oral Suspension | USP, BP |
| Clarithromycin Extended-Release Oral Tablets | USP, BP |
5. Nhà sản xuất API
6. Kinh nghiệm đối với hoạt chất – tương ứng với từng dạng bào chế
Chỉ dành cho tài khoản VIP
6.1. Kinh nghiệm thực tế:
Những lưu ý khi xây dựng công thức:
-
- Có thể sử dụng nguyên liệu clarithromycin đã được tạo hạt che vị.
- Một số tài liệu mô tả phương pháp che vị đắng và bảo vệ clarithromycin khỏi sự phân huỷ của acid dịch vị bằng phương pháp phun sấy để tạo hạt nhưng cần thực nghiệm trên nguồn nguyên liệu nghiên cứu.
6.2. Tài liệu cho xây dựng công thức
-
- Patent US005919489A [4]: mô tả phương pháp tạo hạt nhằm mục đích che đắng cho dược chất, cốm sau tạo hạt có thể dùng để tiếp tục nghiên cứu điều chế hỗn dịch uống.
- Patent WO 2006/030297 A1 [5]: trình bày phương pháp tạo hạt cốm clarithromycin 125 mg/5 ml và 250 mg/ml với mục đích che vị và bảo vệ dược chất tránh ảnh hưởng của môi trường acid dịch vị. Thành phẩm cốm được nghiên cứu tương đương sinh học với biệt dược Biaxin.
- Patent US005705190A [6]: khảo sát thành phần và phương pháp bào chế viên nén clarithromycin 500 mg phóng thích kéo dài. Kết quả sau khi tiến hành nghiên cứu sinh khả dụng và tương đương sinh học, thành phẩm đạt tương đương sinh học với biệt dược Biaxin 250 mg. Hệ tá dược sử dụng tương tự như viên nhân của biệt dược Klacid MR hiện nay.
- Patent EP0973527B1 [7]: khảo sát công thức viên bao phim clarithromycin 500 mg có tác dụng phóng thích kéo dài và giảm hậu vị. Nghiên cứu sinh khả dụng và chứng minh tương đương sinh học với biệt dược Biaxin.
Tài liệu tham khảo
[1] J. M. Zuckerman, F. Qamar, and B. R. Bono, “Macrolides, Ketolides, and Glycylcyclines: Azithromycin, Clarithromycin, Telithromycin, Tigecycline,” Infectious Disease Clinics of North America, vol. 23, no. 4, pp. 997–1026, Dec. 2009, doi: 10.1016/J.IDC.2009.06.013.
[2] Y. Nakagawa, S. Itai, T. Yoshida, and T. Nagai, “Physicochemical properties and stability in the acidic solution of a new macrolide antibiotic, clarithromycin, in comparison with erythromycin,” Chemical & pharmaceutical bulletin, vol. 40, no. 3, pp. 725–728, 1992, doi: 10.1248/CPB.40.725.
[3] R. O. Manani, K. O. Abuga, and H. K. Chepkwony, “Pharmaceutical Equivalence of Clarithromycin Oral Dosage Forms Marketed in Nairobi County, Kenya,” Scientia Pharmaceutica, vol. 85, no. 2, Jun. 2017, doi: 10.3390/SCIPHARM85020020.
[6] “5,705,190 1. CONTROLLED RELEASE FORMULATION FOR POORLY SOLUBLE BASC DRUGS”.
