Nhân viên R&D thường sẽ nhận được yêu cầu nghiên cứu sản phẩm có dạng “Hoạt chất A, hàm lượng B, với dạng bào chế C”. Vậy, chúng ta sẽ làm như thế nào để hoàn thành công việc được giao? Dựa trên những kinh nghiệm thực tế, SEN Pharma xin phép chia sẻ quy trình tổng quát gồm 4 bước chính kèm theo các công việc & kĩ năng cần thiết:
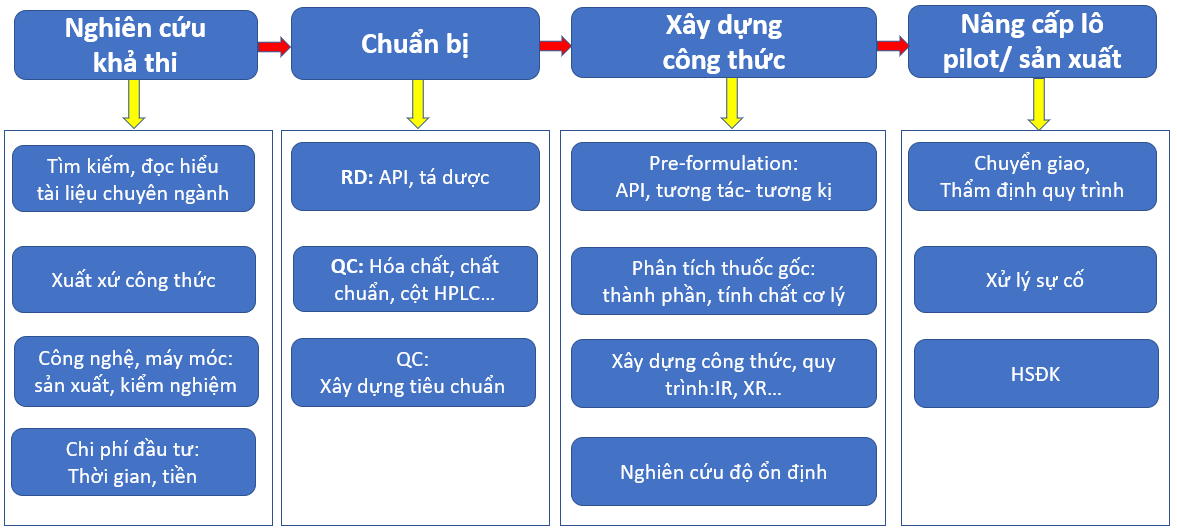
Bước 1: Nghiên cứu khả thi
Khi nhận được yêu cầu nghiên cứu, việc đầu tiên và cũng rất quan trọng là xác định xem yêu cầu đó có khả thi hay không? Nhiệm vụ của R&D là tìm kiếm, đọc hiểu tài liệu để trả lời các câu hỏi chính như:
- Sản phẩm này có đặc điểm gì? Vấn đề chính khi nghiên cứu?
- Có xuất xứ công thức không ?(nếu không đáp ứng yêu cầu theo công văn 2396/QLD-ĐK thì gần như không đăng ký được)
- Có áp dụng công nghệ bào chế hay thiết bị/quy trình kiểm nghiệm đặc biệt? Nếu có thì công ty có đáp ứng được/đầu tư mới không?
- Chi phí đầu tư có vượt quá chi phí nghiên cứu trung bình của 1 sản phẩm? Nếu có thì công ty cân nhắc chưa?…
Đây là những thông tin rất cần thiết để đảm bảo chắc chắn dự án sẽ được thực hiện, tránh gây lãng phí không cần thiết.
Có rất nhiều tình huống, do công ty muốn phát triển những sản phẩm mới, độc đáo trên thị trường, nhưng điều kiện hiện tại không cho phép. Ví dụ như sản phẩm sử dụng công nghệ bao vi hạt; hay dạng bột/viên sủi; cần sử dụng maý ép đùn nóng chảy; hệ tá dược mới; hoặc môi trường pha chế tránh oxi… nhưng công ty không sẵn có.
Bước 2: Chuẩn bị
Khi xác định được dự án khả thi, chúng ta sẽ chuyển qua khâu chuẩn bị để đảm bảo mọi thứ đều sẵn sàng trước khi bắt đầu nghiên cứu bào chế.
- Hoạt động nghiên cứu cần đảm bảo API, tá dược nghiên cứu đã có sẵn. Phần này có thể chủ động liên hệ với các nhà cung cấp và phòng kế hoạch – cung ứng.
- Phối hợp với QC: Xây dựng được tiêu chuẩn sơ bộ. Một số đơn vị hiện nay và cũng là xu hướng tất yếu của các đơn vị lớn đã thiết lập phòng QC-RD để phát triển phương pháp phân tích và tập trung cho lĩnh vực nghiên cứu. Thảo luận và kiểm tra các hóa chất, chất chuẩn, cột HPLC… đã đầy đủ ?
Bước 3: Xây dựng công thức
Đây là phần cực kì quan trọng, đóng vai trò quyết định lớn tới việc thành công của dự án, nên rất rất cần được đầu tư thời gian và công sức. Nhân viên R&D sẽ thực hiện các công việc như:
- Phân tích đặc điểm thuốc gốc (thành phần, quy trình bào chế..).
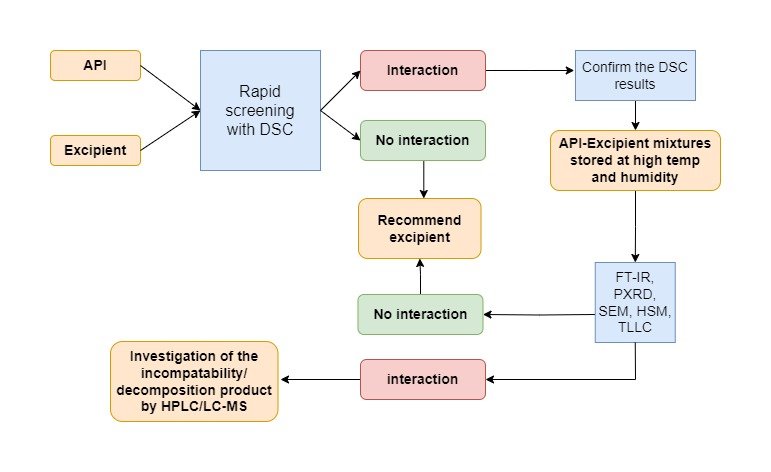
- Nghiên cứu tiền công thức (pre-formulation) để xác định đặc điểm dược chất hoặc tương tác – tương kị…
- Xây dựng công thức, quy trình bào chế.
- Nghiên cứu độ ổn định.
Bước 4: Nâng cấp cỡ lô
Sau khi đạt yêu cầu ở quy mô lab, sản phẩm sẽ được chuyển qua nghiên cứu nâng cấp cỡ lô. Nhân viên R&D sẽ:
- Chuyển giao công thức, thẩm định quy trình sản xuất trên cỡ lô pilot/ sản xuất.
- Xử lý các sự cố gặp phải trong quá trình chuyển giao.
- Một số nơi, nhân viên R&D sẽ có nhiệm vụ phụ trách hoặc hỗ trợ bộ phận đăng kí viết hồ sơ phần P2, P3 – sản xuất và trả lời các yêu cầu kèm theo.
Như vậy, phát triển một sản phẩm thuốc generic sẽ trải qua nhiều giai đoạn và cần có những kiến thức, kĩ năng nhất định. Mọi thứ sẽ được tích lũy dần trong suốt quá trình làm việc.