Giới thiệu chung
Khi đề cập đến nhóm thuốc ức chế SGLT2, dapagliflozin được biết đến là 1 hoạt chất tiềm năng trong điều trị tiểu đường type 2 với tên thương mại Farxiga®. Bên cạnh công dụng kiểm soát đường huyết, dapagliflozin đã được chứng minh có hiệu quả đối với bệnh nhân suy tim và suy thận mãn tính, biến hoạt chất này trở thành mục tiêu nghiên cứu của nhiều nhà sản xuất thuốc generic khi thời hạn bảo hộ độc quyền của Farxiga® gần kết thúc.
Bài viết về hoạt chất dapagliflozin và thuốc gốc Farxiga® do SEN Pharma tổng hợp sẽ cung cấp các thông tin hết sức thú vị về:
- Tổng quan về hoạt chất dapagliflozin
- Quá trình nghiên cứu và phát triển của thuốc gốc Farxiga®
- Kết quả kinh doanh của thuốc gốc Farxiga® kể từ khi ra mắt
- Những lưu ý trong quá trình nghiên cứu thuốc genenic dapagliflozin
SEN Pharma tự hào là đối tác của Unipharm, nhà phân phối nguyên liệu hàng đầu tại Trung Quốc hiện đang sở hữu nguồn nguyên liệu dapagliflozin chất lượng, đầy đủ tài liệu và giá thành hợp lý. Với mạng lưới hơn 100 nhà máy sản xuất nguyên liệu tại Trung Quốc và danh mục hơn 700 APIs, Unipharm sẽ là đối tác tiềm năng cho các nhà máy sản xuất Dược phẩm tại Việt Nam không chỉ đối với dapagliflozin mà còn nhiều dược chất khác.
Tổng quan về dapagliflozin [1]
Farxiga® (dapagliflozin) là thuốc ức chế chọn lọc kênh đồng vận chuyển glucose và natri 2 (SGLT2), có khả năng tác động độc lập với insulin trong việc loại bỏ phần glucose dư thừa trong cơ thể, biến đây trở thành một cơ chế hết sức khác biệt so với các thuốc điều trị tiểu đường type 2 xuất hiện trước đó. Farxiga® (dapagliflozin) là 1 trong những hợp chất ức chế SGLT2 đầu tiên được chấp thuận sử dụng trong điều trị bên cạnh Invokana® (canagliflozin) và Jardiance® (empagliflozin)
Farxiga® hiện được chỉ định điều trị 1 viên mỗi ngày nhằm kiểm soát đường huyết ở người lớn, cùng với thay đổi lối sống hoặc kết hợp với các thuốc hạ đường huyết khác (bao gồm cả insulin), hoặc đối với các trường hợp không cải thiện khi điều trị bằng metformin.
Quá trình nghiên cứu thuốc gốc Farxiga [1]–[6]
Ngày 11 tháng 1 năm 2007, Bristol-Myers Squibb và AstraZeneca tuyên bố đang cùng nghiên cứu và phát triển 2 hợp chất tiềm năng trong điều trị tiểu đường type 2. Sau đó, hoạt chất dapagliflozin lần đầu được giới thiệu tại hội thảo của Tổ chức Tiểu đường Hoa Kì (American Diabetes Association) vào ngày 25 tháng 6 năm 2007.
Ngày 14 tháng 11 năm 2012, Farxiga® chính thức được chấp thuận tại thị trường Châu Âu với chỉ định ban đầu giúp kiểm soát đường huyết ở bệnh nhân tiểu đường type 2.
Ngày 8 tháng 1 năm 2014, FDA chính thức chấp thuận đưa Farxiga® vào điều trị. Quá trình phê duyệt bị kéo dài của Farxiga® tại cơ quan này được giải thích bởi sự thiếu sót dữ liệu lâm sàng, ảnh hưởng tới việc đánh giá toàn diện. Nó cũng gây ra khó khăn cho việc cân nhắc giữa lợi ích – nguy cơ của thuốc này khi được đưa vào sử dụng trong thực tế.
Ngày 21 tháng 10 năm 2019, AstraZeneca thông báo Farxiga® đã được FDA công nhận là giúp giảm nguy cơ nhập viện do suy tim đối với bệnh nhân tiểu đường type 2 và tim mạch tiến triển.
Ngày 30 tháng 4 năm 2021, FDA công nhận thêm 1 chỉ định mới của Farxiga® trong việc điều trị bệnh suy thận mãn tính (CKD) ở bệnh nhân có hoặc không mắc tiểu đường.
Bên cạnh dạng đơn chất, Bristol-Myers Squibb và AstraZeneca còn kết hợp dapagliflozin với các hoạt chất điều trị tiểu đường khác, với các tên thương mại nổi tiếng như:
- Qtern (dapagliflozin/saxagliptin) ra mắt ngày 27 tháng 2 năm 2017.
- Xigduo XR (dapagliflozin/metformin) ra mắt ngày 29 tháng 10 năm 2014.
- Qternment XR (dapagliflozin/metformin/saxagliptin) ra mắt ngày 2 tháng 5 năm 2019.
Tình hình kinh doanh của Farxiga từ khi ra mắt [1], [7]–[10]
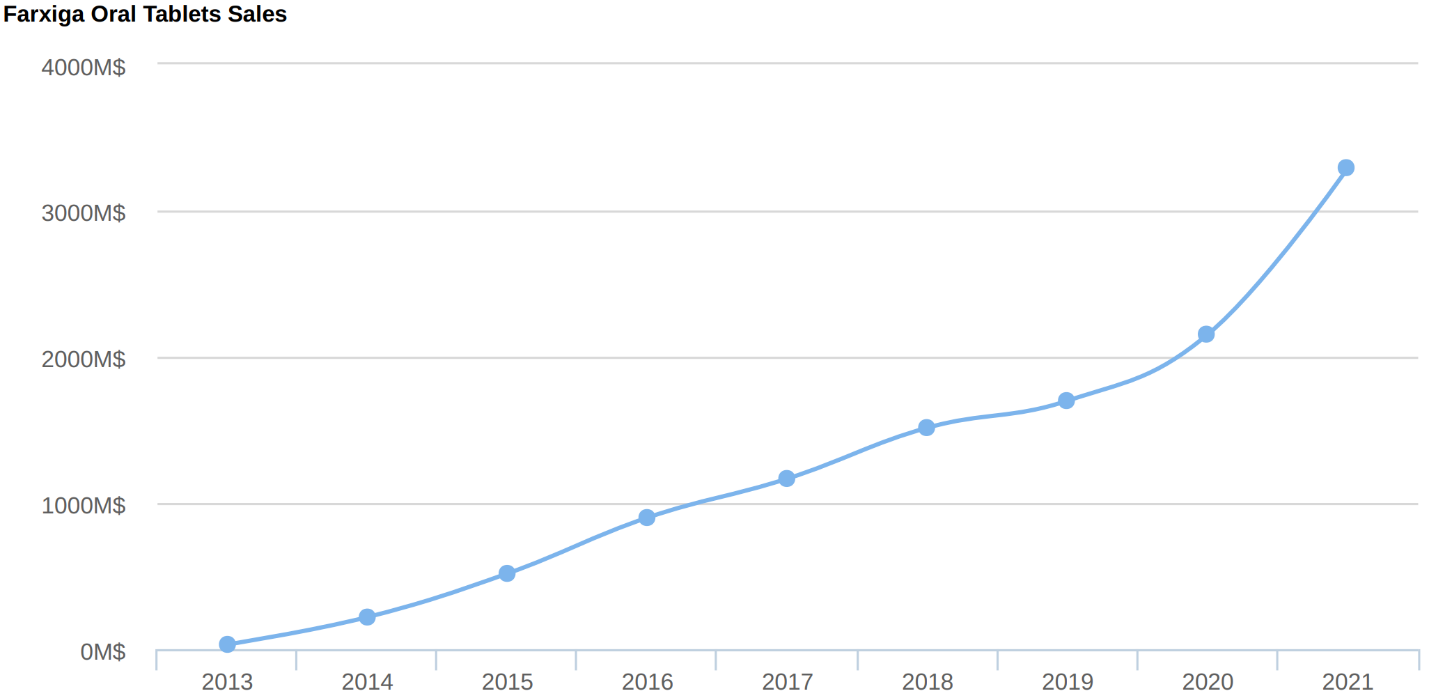
Kể từ khi ra mắt đến năm 2019, doanh thu của Farxiga® tăng trưởng hết sức ổn định qua từng năm. Tuy nhiên, trong giai đoạn từ 2020 đến nay, doanh thu của thuốc này đã có bước nhảy vọt mạnh mẽ khi đạt gần 3,5 tỷ đô la trong năm 2021, chiếm 25,3% thị trường thuốc ức chế SGLT2 trên toàn cầu. Điều này đến từ việc Farxiga® nói riêng và các thuốc ức chế SGTLT2 nói chung được tăng cường sử dụng trong bối cảnh đại dịch COVID 19 phức tạp.
Nhờ việc được công nhận hiệu quả đối với bệnh nhân suy thận mãn tính và suy thận, doanh thu của Farxiga® được dự đoán sẽ còn tăng trưởng mạnh mẽ trong những năm tới khi thuốc này bắt đầu được sử dụng trên nhiều đối tượng bệnh nhân hơn. Chỉ riêng trong quý I năm 2022, Farxiga® lần đầu tiên mang lại doanh thu 1 tỷ đô la cho AstraZeneca, vượt dự đoán của Wall Street đến 20%.
Giá bán lẻ hiện nay của Farxiga® tại thị trường Việt Nam là khoảng 20 nghìn VND cho 1 viên (đối với cả liều 5mg & 10mg)
Những lưu ý khi nghiên cứu thuốc generic dapagliflozin [11]–[13]
Farxiga là sản phẩm đồng hợp tác giữa Bristol-Myers Squibb và AstraZeneca nên 2 công ty này đang cùng sở hữu nhiều patent liên quan đến hoạt chất và bào chế, tiêu biểu như
- Patent hoạt chất: US 6515117B2 C-aryl glucoside SGLT2 inhibitors and method, ngày hết hạn 10/4/2025
- Patent bào chế : US 7851502B2 Pharmaceutical formulations containing an SGLT2 inhibitor, ngày hết hạn 19/8/2028
Bạn đọc có thể tham khảo thông tin của Farxiga® về thành phần, tỷ lệ nguyên liệu trong công thức, quy trình sản xuất ở chuyên mục Thư viện – Thuốc gốc trên website của SEN Pharma.
Để chuẩn bị cho quá trình nghiên cứu công thức và nộp hồ sơ đăng kí thì các công ty sản xuất thuốc generic ở Việt Nam đã bắt đầu tìm kiếm nguồn nguyên liệu dapagliflozin nhằm đáp ứng nhu cầu điều trị trong nước ngay khi patent hoạt chất hết hiệu lực (khoảng giữa năm 2025).
Để tăng khả năng nghiên cứu thành công, cần chú ý một số vấn đề được nêu trong assessment report của thuốc gốc Farxiga®:
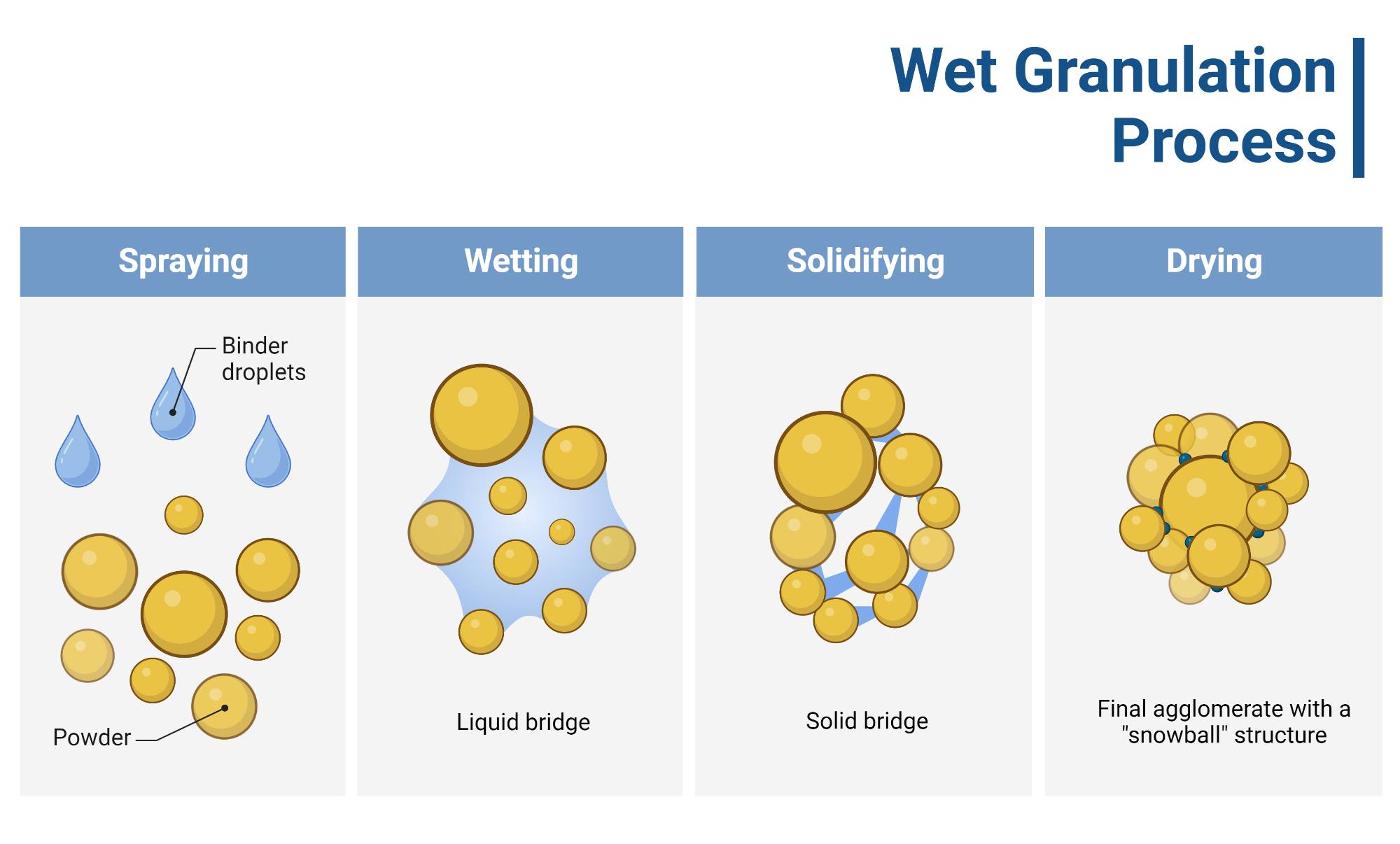
- Dạng đa hình (Polymorphic form): Việc biến đổi dạng thù hình từ dạng tinh thể (crystalline) sang dang vô định hình (amorphous) có thể xảy ra khi bị ảnh hưởng bởi nhiệt độ cao trong thời gian dài. Việc biến đổi này tiềm tàng có thể gây ảnh hưởng tới định lượng, đồng đều hàm lượng, độ hoà tan và lượng tạp chất sinh ra. Tuy nhiên, khi so sánh độ hoà tan in-vitro và tương đương sinh học giữa mẫu viên lưu ở điều kiện bình thường và viên chịu tác động của nhiệt, việc biến đổi dạng thù hình không ảnh hưởng đến các thông số chất lượng của sản phẩm thuốc.
- Kích thước hạt: Việc kiểm soát dải phân bố kích thước hạt của hoạt chất trong quá trình sản xuất là cực kì cần thiết vì thông số này ảnh hưởng rất lớn đến độ đồng đều hàm lượng.
- Tính chảy kém, bết dính của của hoạt chất: Ảnh hưởng tới định lượng và độ đồng đều hàm lượng. Do đó, việc lựa chọn khung tá dược và phương pháp sản xuất phù hợp cần được nghiên cứu kĩ càng.
- Hàm lượng hoạt chất thấp: Ảnh hưởng lớn tới độ đồng đều hàm lượng, do đó cần phát triển quy trình sản xuất đảm đảo độ đồng đều của cốm sau khi trộn.
- Hoạt chất nhạy cảm với ẩm và các tá nhân oxy hoá trong tá dược: Cần lựa chọn khung tá dược tương thích và hàm ẩm phù hợp. Ngoài ra, việc sử dụng bao bì cấp 1 chống ẩm tốt và/ hoặc trang bị thêm túi hút ẩm cũng có thể được áp dụng.
Tài liệu tham khảo
- [1] “Home – PharmaCircle.” https://www.pharmacircle.com/info/ (accessed Jan. 05, 2023).
- [2] “Farxiga (dapagliflozin) FDA Approval History – Drugs.com.” https://www.drugs.com/history/farxiga.html (accessed Feb. 04, 2023).
- [3] “Qtern: Uses, Dosage, Side Effects & Warnings – Drugs.com.” https://www.drugs.com/qtern.html (accessed Feb. 04, 2023).
- [4] “Xigduo XR: Uses, Dosage & Side Effects – Drugs.com.” https://www.drugs.com/xigduo-xr.html (accessed Feb. 04, 2023).
- [5] “Qternmet XR: Uses, Dosage, Side Effects, Warnings – Drugs.com.” https://www.drugs.com/qternmet-xr.html (accessed Feb. 04, 2023).
- [6] H. J. L. Heerspink et al., “Dapagliflozin in Patients with Chronic Kidney Disease,” New England Journal of Medicine, vol. 383, no. 15, pp. 1436–1446, Oct. 2020, doi: 10.1056/NEJMOA2024816.
- [7] “Website chính thức của Cục Quản Lý dược, Bộ Y Tế.” https://drugbank.vn/thuoc/Forxiga&VN3-38-18 (accessed Feb. 04, 2023).
- [8] “Website chính thức của Cục Quản Lý dược, Bộ Y Tế.” https://drugbank.vn/thuoc/Forxiga&VN3-37-18 (accessed Feb. 04, 2023).
- [9] “Sodium-dependent Glucose Co-transporter 2 (SGLT 2) Market Analysis – Industry Report – Trends, Size & Share.” https://www.mordorintelligence.com/industry-reports/sglt-2-market (accessed Feb. 04, 2023).
- [10] “AstraZeneca’s Farxiga hits $1B quarterly mark, but flagship oncology and China units lag | Fierce Pharma.” https://www.fiercepharma.com/pharma/astrazenecas-farxiga-hits-1b-quarterly-mark-flagship-oncology-china-businesses-pull-back (accessed Feb. 04, 2023).
- [11] “Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations.” https://www.accessdata.fda.gov/scripts/cder/ob/patent_info.cfm?Product_No=001&Appl_No=202293&Appl_type=N (accessed Feb. 04, 2023).
- [12] “Generic Farxiga Availability – Drugs.com.” https://www.drugs.com/availability/generic-farxiga.html (accessed Feb. 04, 2023).
- [13] E. Medicines Agency, “Committee for Medicinal Products for Human Use (CHMP) Assessment report Forxiga dapagliflozin”, Accessed: Feb. 04, 2023. [Online]. Available: www.ema.europa.eu