Trong quá trình nghiên cứu và phát triển thuốc, việc tìm kiếm thông tin tham khảo liên quan tới dược lý- lâm sàng và đặc biệt là bào chế là rất quan trọng, góp phần tăng xác suất thành công khi phát triển sản phẩm mới.
Với mong muốn giới thiệu tới các đồng nghiệp một số tài liệu tham khảo phục vụ quá trình nghiên cứu và phát triển thuốc, SEN Pharma hy vọng có thể góp phần nâng cao chất lượng và tốc độ nghiên cứu thuốc generic tại Việt Nam, giúp người dân có nhu cầu sớm được sử dụng thuốc với chất lượng tốt và giá thành hợp lý.
Dưới đây là một số tài liệu tham khảo thường được sử dụng:
| STT | Tên tài liệu | Địa chỉ | Nội dung cung cấp |
|
1 |
Website pubchem | https://pubchem.ncbi.nlm.nih.gov/ | Tính chất lý hóa của dược chất, biệt dược gốc, patent liên quan… |
|
2 |
Website drugbank | https://go.drugbank.com/ | Thông tin rất đa dạng: thông tin dược lý của thuốc, các thuốc đang lưu hành chứa dược chất, các dạng đơn chất và dạng phối hợp của dược chất, tính chất lý hóa… |
|
3 |
Dược điển online | Website drugfuture.com/standard | Tiêu chuẩn kiểm nghiệm dược chất, thành phẩm trong các dược điển (USP, BP, EP, JP, IP) |
|
4 |
Tờ hướng dẫn sử dụng thuốc lưu hành tại các quốc gia | Anh (MHRA, EMC)
Pháp (ANSM) Châu Âu (EMA) Mỹ (Dailymed) Australia (TGA) |
Thông tin cơ bản của thuốc: dược lý-dược lâm sàng, mô tả thuốc, hệ tá dược, bao bì đóng gói và hạn sử dụng.
Chú ý: Dailymed không có thông tin liên quan tới hạn sử dụng của thuốc, TGA tương đối khó tìm hạn sử dụng của thuốc nên ít được ưu tiên hơn. |
|
5 |
Thông tin trực quan về các thuốc lưu hành tại Mỹ | Website drugs.com | Hình ảnh, kích thước của thuốc tham khảo, và một số thông tin khác. Từ đó giúp xây dựng cảm quan thuốc generic dự kiến phát triển |
|
6 |
Báo cáo đánh giá (Assessment report) của các cơ quan quản lý (EMA, TGA…) | Châu Âu (EMA)
Australia (TGA) Hà Lan (CBG-MEB) Hoặc sử dụng google tìm kiếm (*) |
Thông tin về toàn bộ quá trình nghiên cứu và phát triển của sản phẩm (bao gồm thuốc gốc hoặc thuốc generic).
Một số thông tin nên chú ý: đặc điểm lý hóa, độ ổn định của dược chất; quá trình phát triển thành phẩm (lựa chọn tá dược, quy trình bào chế, thử nghiệm lâm sàng….) |
|
7 |
Orange book – FDA(**) | Orange book | Thông tin về thuốc tham chiếu tại Mỹ; danh sách bằng sáng chế (patent) của thuốc và thời hạn được bảo hộ của các bằng sáng chế |
|
8 |
Patent trên thế giới | Châu Âu: https://epo.org/
Mỹ: https://www.freepatentsonline.com/ Thế giới: https://patentscope.wipo.int/ |
Thông tin về các patent hóa dược, bào chế… liên quan tới thuốc gốc hoặc thuốc generic. |
|
9 |
Bài báo khoa học | https://www.sciencedirect.com/ | Thông tin đa dạng: tính chất lý hóa của API, nghiên cứu stress test, nghiên cứu tương tác API-tá dược, các công thức thử nghiệm và kết quả…. |
(*) Dược sỹ sử dụng google tìm kiếm theo cú pháp: tên API + dạng bào chế + “assessment report” + EMA, TGA…
(**) Dược sỹ có thể tìm hiểu thêm các thông tin hưu ích liên quan tới cách sử dụng orange book thông qua 1 buổi chia sẻ (sharing session) do FDA tổ chức tại đây


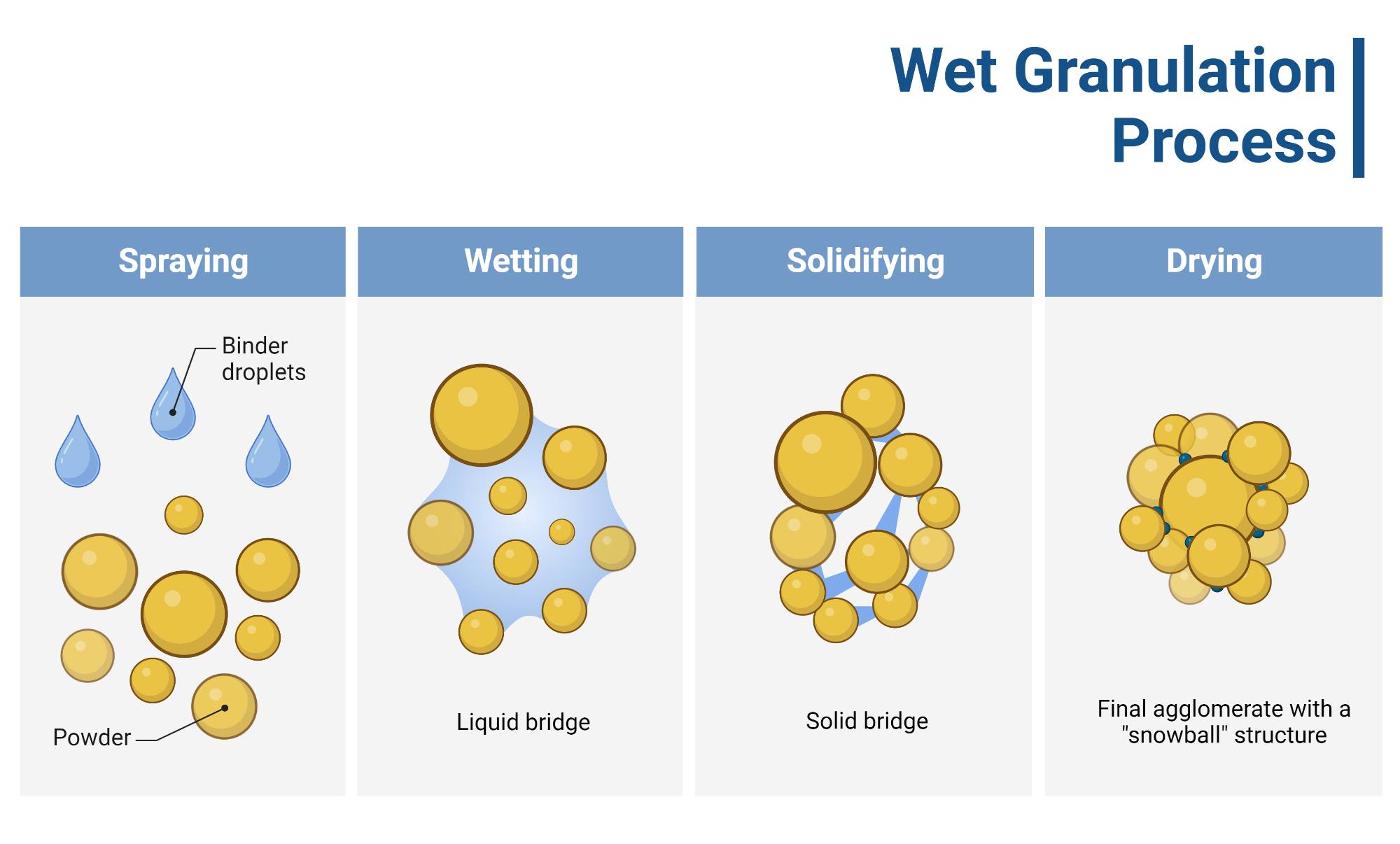

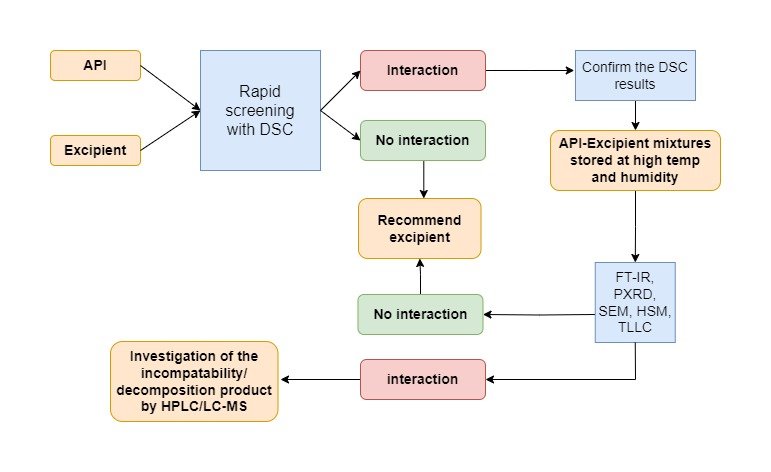
Thông tin rất hữu ích, cảm ơn admin đã tổng hợp nhé!