Tại phiên họp báo thường kỳ tháng 9 của Chính phủ, Thứ trưởng Bộ Y tế Nguyễn Thị Liên Hương đã có câu trả lời báo chí về các giải pháp hỗ trợ của Bộ Y tế cho các bệnh viện giải quyết tình trạng thiếu thuốc trong khi chưa sửa đổi Luật Đấu thầu. Đó là:
- Đôn đốc, hướng dẫn công tác mua sắm, đầu thầu tại các địa phương.
- Cấp phép, quản lý giá thuốc, trang thiết bị y tế, nhất là đối với các thuốc hiếm.
- Đề xuất Chính phủ ban hành cơ chế đặc thù về dự trữ đối với một số loại thuốc hiếm, thuốc cần thiết điều trị các bệnh hiếm gặp.
Đặc biệt, cần có chính sách khuyến khích doanh nghiệp dược trong nước sản xuất thuốc hiếm để chủ động nguồn cung trong nước. Theo Thông tư 26/2019/TTBYT, danh mục thuốc hiếm hiện có 214 thuốc với gần 2/3 là thuốc dùng đường tiêm và còn lại là thuốc dùng đường uống.

Ngành dược của Việt Nam còn nhiều dư địa để phát triển
Riêng đối với hoạt động nghiên cứu và sản xuất thuốc tại Việt Nam, trước đó, trong cuộc làm việc của Phó Thủ tướng Vũ Đức Đam về Chương trình phát triển công nghiệp dược, dược liệu sản xuất trong nước đến năm 2030, ông Vũ Tuấn Cường, Cục trưởng Cục Quản lý dược cho biết Việt Nam hiện đang chi rất nhiều tiền để nhập khẩu thuốc phát minh, thuốc công nghệ cao, thuốc chuyên khoa, đặc trị.
Trong khi đó, thuốc trong nước chỉ chiếm 45% tổng giá trị tiền thuốc điều trị. Theo ông Cường, hiện nay, Việt Nam có 228 nhà máy sản xuất dược đạt tiêu chuẩn GMP-WHO, trong đó 14,3% tự động hoá hoàn toàn, 68,1% có thiết bị tự động. Các doanh nghiệp dược phẩm chủ yếu đang tập trung sản xuất thuốc tương đương thuốc phát minh (thuốc generic), chưa chú trọng vào nghiên cứu sản xuất thuốc công nghệ cao, thuốc mới, thuốc chuyên khoa đặc trị, thuốc phát minh…
Trong khi đó, tại thị trường dược Việt Nam, tốc độ tăng trưởng bình quân của ngành công nghiệp dược vào khoảng 10 – 12%. Tổng giá trị thuốc ước tính sử dụng là 6,92 tỷ USD vào năm 2021, tương đương 73 USD/người.
Theo dự báo của Fitch Solutions, chi tiêu cho chăm sóc sức khỏe tại Việt Nam năm 2022 có thể đạt 22,4 tỷ USD. Đến 2031, con số này có thể đạt 37,7 tỷ USD, với tăng trưởng hàng năm khoảng 7,8%. Như vậy, dư địa để phát triển trong ngành dược cho các doanh nghiệp còn rất lớn.
Nguồn:
https://thuvienphapluat.vn/van-ban
Thông tin bổ sung:
1. Tiêu chí lựa chọn thuốc vào danh mục Thuốc hiếm ở Việt Nam
Một thuốc được xem xét để lựa chọn vào Danh mục thuốc để phòng, chẩn đoán, điều trị bệnh hiếm gặp khi đáp ứng một trong các tiêu chí sau đây:
a) Thuốc để phòng, chẩn đoán, điều trị bệnh hiếm gặp theo quy định của Bộ trưởng Bộ Y tế;
b) Thuốc có chỉ định được phân loại và cấp phép lưu hành là thuốc hiếm bởi một trong các cơ quan quản lý tham chiếu.
2. Chính sách phát triển thuốc hiếm ở Mỹ
Để thúc đẩy đầu tư nghiên cứu thuốc hiếm của các công ty dược, FDA đã ban hành Quy định Orphan Drug Act (ODA) năm 1983 đã làm thay đổi đáng kể sự . Từ đó đến nay, ODA đã có những tác động đáng kể đến quá trình nghiên cứu sản xuất thuốc hiếm. Sau đây là 5 điểm đặc biệt của ODA:
- Mục đích
ODA nhằm khuyến khích các công ty tham gia vào hoạt động nghiên cứu và sản xuất thuốc hiếm. Ở Mỹ, bệnh hiếm là bệnh có ảnh hưởng ít hơn 200.000 bệnh nhân/năm. Do chi phí và thời gian nghiên cứu lớn nhưng quy mô thị trường thấp nên các công ty ít quan tâm nghiên cứu. Điều này dẫn đến sự thiếu hụt các loại thuốc điều trị.
- Sáng kiến quan trọng của ODA
Đó là chấp nhận thời hạn độc quyền thị trường 7 năm cho 1 loại thuốc mới để điều trị bệnh hiếm đầu tiên. Đồng thời, có nhiều ưu đãi về thuế cho các công ty trong thời gian nghiên cứu.
- Tác động
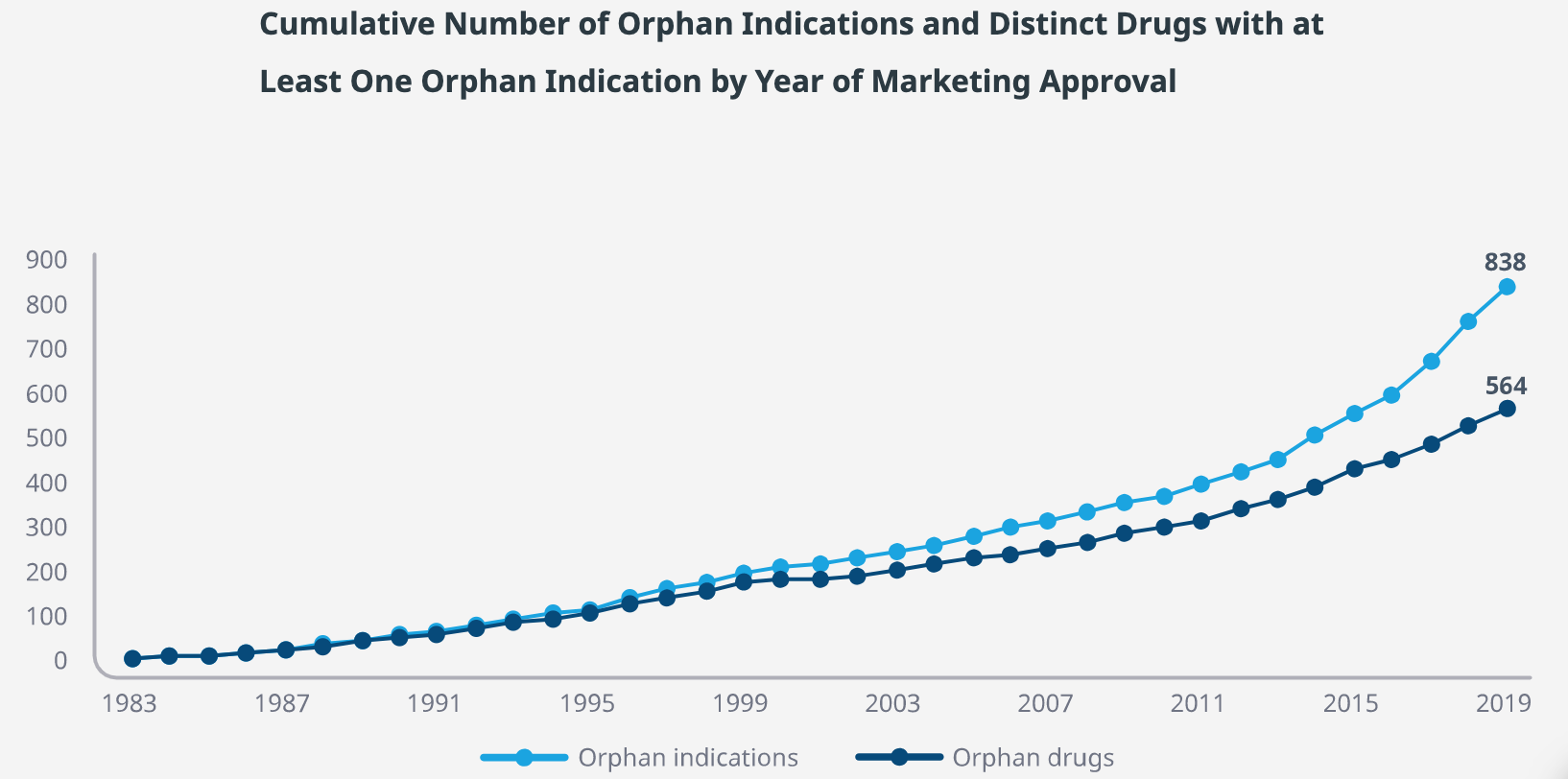
Các công ty bắt đầu từng bước tiến vào thị trường thuốc hiếm. Giai đoạn từ năm 1983 đến 2008: có 333 thuốc được phê duyệt. Trong khi đó, chỉ mất 8 năm (từ 2009 đến 2017) có 334 thuốc được phê duyệt. Hiện nay, số lượng thuốc hiếm được nghiên cứu và phê duyệt tiếp tục gia tăng.
- Tranh luận và đánh giá lại về ODA
ODA không phải tốt đẹp cho tất cả. America’s Health Insurance Plans cho rằng ODA là “trò chơi mang tính hệ thống”: các công ty tìm cách tối đa hoá lợi nhuận với chi phí đắc đỏ và nghiên cứu thay đổi mục tiêu điều trị của các thuốc đã được phê duyệt. Điều này đã gây áp lực lớn lên hệ thống bảo hiểm và bệnh nhân.
Năm 2018, Scott Gottlieb (thành viên FDA) nêu quan điểm “Chúng ta đang khuyến khích phát triển thuốc hiếm một cách đúng đắng bằng ODA?”. Và hãy cùng chờ xem Việt Nam sẽ có các chính sách phát triển thuốc hiếm ở Việt Nam như thế nào?
Nguồn:
Investigating the landscape of US orphan product approvals
5 Things About the Orphan Drug Act